El análisis genético de tan escaso número de mutaciones patógenas sólo sirve para descartar si el paciente tiene alguna de ellas.
Pero si no se encuentra ninguna de estas mutaciones, no se puede CONCLUIR que ese paciente en particular NO TIENE UNA ENFERMEDAD MITOCONDRIAL.
Esta aclaración es MUY IMPORTANTE, para los pacientes con SOSPECHA DE ENFERMEDAD MITOCONDRIAL causada por mutaciones en el ADNmt, y también para especialista en Neurología y/o en enfermedades Neuromusculares, y para cualquier médico que solicite un análisis genético del ADNmt a un laboratorio de la Seguridad Social o privado y le hagan solamente este tipo de análisis.
TABLA 1 Secuenciación de un pequeño número de reconocidas mutaciones patógenas (20 mutaciones ) en un escaso número de genes (9 genes) del ADNmt, se le ha denominado MINISECUENCIACIÓN.
Se suele decir “una imagen vale más que mil palabras” afirmando que una sola imagen puede transmitir ideas complejas o un significado o la esencia de algo de manera más efectiva que una mera descripción verbal o textual.
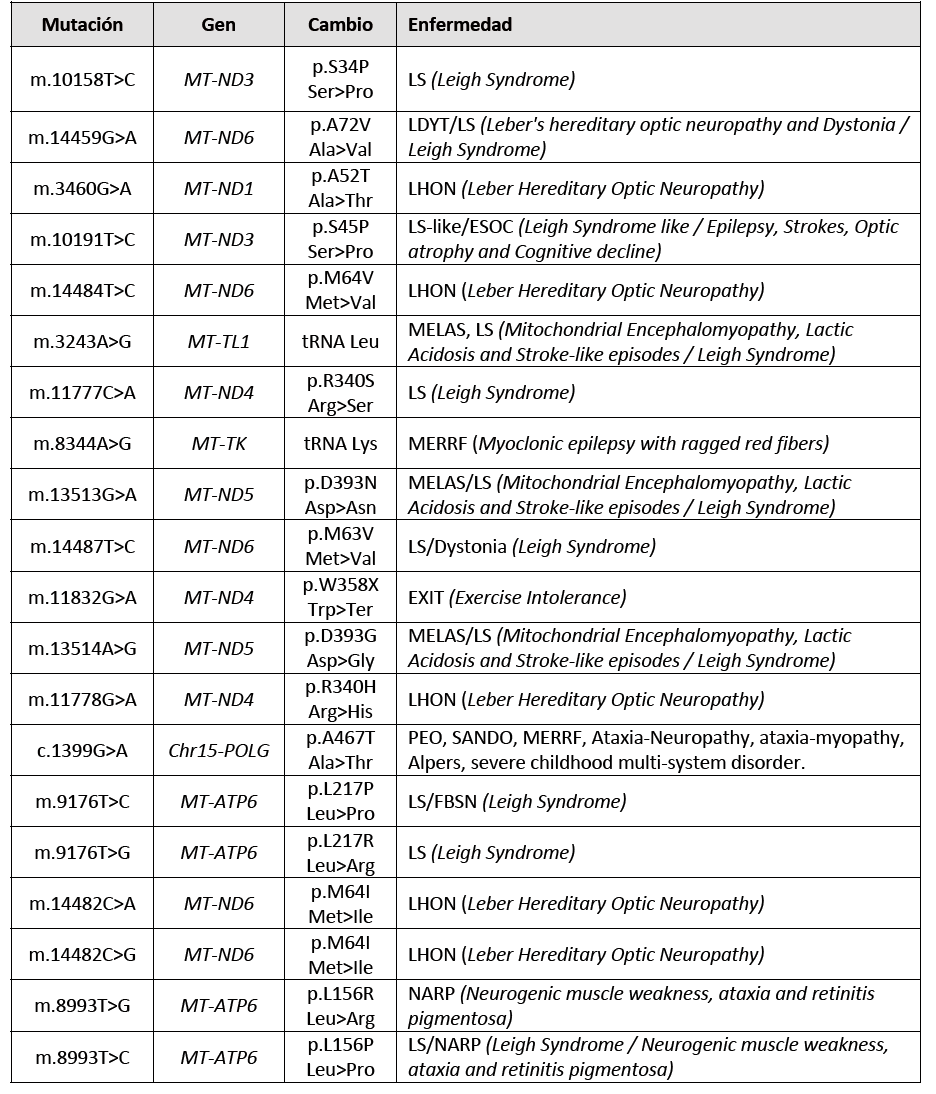
TABLE 2. En esta tabla, se exponen 21 mutaciones patógenas más frecuentes en 6 genes del ADN mitocondrial. Como se puede observar refieren más mutaciones en menos genes del ADNmt
|
Mutación |
Gen |
Cambio de base |
Enfermedad Mitocondrial |
|
m. 3243A>G |
MT-TL1 |
ARNt Leu (UUR) (UUA/G) |
MELAS, MIDD, CPEO, MM |
|
m. 3460G> A |
MT-ND1 |
p.Ala52Thr |
LHON |
|
m. 3697G> A |
MT-ND1 |
p. Gly131Ser |
MELAS |
|
m. 3946G> A |
MT-ND1 |
Glu214Lys |
MELAS |
|
m. 3949T> C |
MT-ND1 |
Tyr215His |
MELAS |
|
m. 8993T> G |
MT-ATP6 |
Leu156Arg |
NARP |
|
m. 8993T> C |
MT-ATP6 |
Leu156Pro |
NARP, enfermedad de Leigh |
|
m. 9176T> C |
MT-ATP6 |
Leu217Pro |
FBSN, enfermedad de Leigh |
|
m. 9176T> G |
MT-ATP6 |
Leu217Arg |
Enfermedad de Leigh |
|
m. 10158T> C |
MT-ND3 |
Ser34Pro |
Enfermedad de Leigh |
|
m. 10191T> C |
MT-ND3 |
Ser45Pr |
ESOC, enfermedad similar a Leigh |
|
m. 11777C> A |
MT-ND4 |
Arg340Ser |
Enfermedad de Leigh |
|
m. 11778G> A |
MT-ND4 |
Arg340His |
LHON (mutación homoplásmica) |
|
m. 11832G> A |
MT-ND4 |
Trp358Ter |
Intolerancia al ejercicio |
|
m. 12706T> C |
MT-ND5 |
p.Phe124Leu |
Enfermedad de Leigh |
|
m. 13513G> A |
MT-ND5 |
p.Asp393Asn |
MELAS, Enfermedad de Leigh |
|
m. 14459G> A |
MT-ND6 |
p.Ala72Val |
LYDT, enfermedad de Leigh |
|
m. 14482C> A |
MT-ND6 |
p. Met641Ile |
LHON |
|
m. 14482C> G |
MT-ND6 |
p. Met641Ile |
LHON |
|
m. 14484T> C |
MT-ND6 |
p.Met64Val, |
LHON |
|
m. 14487T> C |
MT-ND6 |
p.Met63Val |
Distonía, enfermedad de Leigh |
Esta figura puede proporcionarnos una visión panorámica
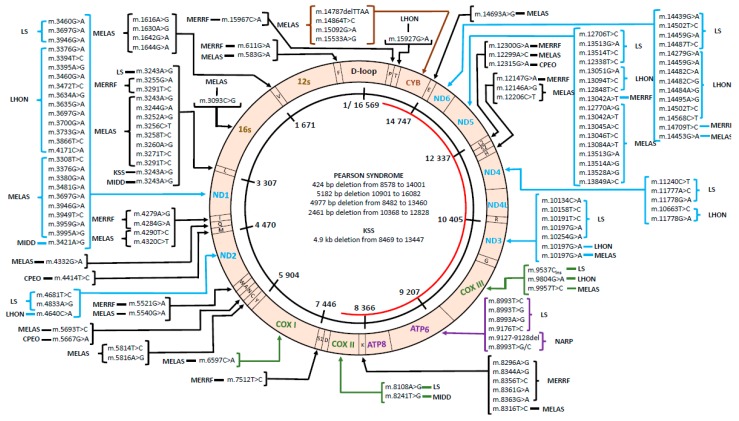
MINISECUENCIACIÓN o Técnica Secuenciación de ADN seleccionado
Propiedades
- Detecta variantes genéticas en un conjunto de genes predeterminados.
- Se requiere una cantidad relativamente pequeña de secuenciación y análisis de datos.
- Se puede aplicar fácilmente a un gran número de pacientes.
Limitaciones
- Solo se analizan las regiones de ADN preseleccionadas.
Esta MINISECUENCIACIÓN no debe considerarse un sustituto de la secuenciación completa del genoma mitocondrial.
Independientemente del método de secuenciación, la especificidad del tejido que puede ocurrir en los trastornos mitocondriales relacionados con el mtDNA puede ser un desafío.
- Esto significa que el diagnóstico de una enfermedad mitocondrial relacionada con el mtDNA se puede pasar por alto en la sangre debido a un nivel bajo de heteroplasmia.
- En estos casos, pueden ser útiles diferentes tejidos del paciente (células epiteliales de la vejiga de la orina, células de la mucosa, tejido muscular o fibroblastos).
Las mutaciones del ADNmt se clasifican en deleción única / duplicación y mutaciones puntuales heteroplásmicas u homoplásmicas.
Mutaciones de ADN mitocondrial
|
Mutación del mtDNA |
Homoplasmia o heteroplasmia |
Patrón de herencia |
Riesgos de recurrencia |
|
Deleciones grandes |
Heteroplásmica |
Esporádica |
<1/24 La transmisión puede ser a través de una molécula de mtDNA duplicada intermedia. |
|
Mutación puntual |
Homoplásmica |
Materna |
Penetrancia reducida variable. Evidencia de que las exposiciones ambientales modulan la penetración. Predominio masculino en la neuropatía óptica hereditaria de Leber (LHON) |
|
Mutación puntual |
Heteroplásmica |
Materna |
La penetrancia variable se correlaciona con el nivel de heteroplasmia. |
|
Mutación puntual |
Heteroplásmica |
Esporádica |
Las mutaciones específicas de tejido generalmente afectan solo al músculo esquelético, con poca o ninguna recurrencia |
Síndromes clínicos causados por mutaciones del ADN mitocondrial
|
Síndrome Clínico |
Características clínicas |
Edad de comienzo |
Mutaciones |
|
Oftalmoplejía externa progresiva crónica (CPEO) |
Ptosis, oftalmoparesia. A menudo presenta miopatía proximal. Varias otras características clínicas pueden estar presentes de forma variable |
Cualquier edad de aparición. Fenotipo típicamente más severo con inicio más joven |
Deleciones simples de ADNmt Mutaciones puntuales del mtDNA (incluyendo m.3243A> G, m.8344A> G) |
|
Síndrome de Kearns-Sayre (KSS) |
Oftalmoplejía externa progresiva (PEO), ptosis, retinopatía pigmentaria, anomalía de la conducción cardíaca, ataxia, proteína elevada en el LCR, diabetes mellitus, hipoacusia neurosensorial, miopatía |
<20 años |
Deleciones simples de ADNmt |
|
Neuropatía óptica hereditaria de Leber (LHON) |
Pérdida de visión bilateral indolora subaguda; hombres: mujeres aprox. 4: 1; Distonía; Síndromes de preexcitación cardíaca |
Entre los 20 y 30 años (media 24 años) |
Mutaciones puntuales del mtDNA (m.11778G> A, m.14484T> C, m.3460A> G y otras mutaciones puntuales raras en ~ 5%) |
|
Encefalopatía mitocondrial, acidosis láctica, episodios similares a accidentes cerebrovasculares (MELAS) |
Episodios similares a un accidente cerebrovascular con encefalopatía, migraña, convulsiones. Presencia variable de miopatía, miocardiopatía, sordera, endocrinopatía, ataxia. Una minoría de pacientes tiene Oftalmoplejía externa progresiva |
Por lo general, <40 años de edad, pero en la infancia es más común |
Mutaciones puntuales del mtDNA (m.3243A> G en 80%, m.3256C> T, m.3271T> C, m.4332G> A, m.13513G> A, m.13514A> G) |
|
Mioclonías, epilepsia y fibras rojas rasgadas (MERRF) |
Mioclonías sensibles al estímulo, convulsiones generalizadas, ataxia, miocardiopatía. Una minoría de pacientes tiene PEO. |
Adolescencia o vida adulta temprana |
mutaciones puntuales del mtDNA m.8344A> G la más comun; m.8356T> C, m.12147G> A) |
|
Debilidad neurogénica con ataxia y retinitis pigmentosa (NARP) |
Ataxia, retinopatía pigmentaria, debilidad |
Infancia o vida adulta temprana |
Mutación puntual MTATP6 generalmente en m.8993T> G |
Hace años, surgió la opinión de que la base molecular de las enfermedades mitocondriales en adultos era ampliamente conocida y que los fenotipos clínicos sindrómicos habían sido bien descritos.
Nada podría haber estado más lejos de la verdad.
El estudio de grandes cohortes de pacientes ha revelado nuevos aspectos de la presentación clínica que antes no se apreciaban. Con el tiempo, este enfoque está comenzando a proporcionar una comprensión precisa de la historia natural de la enfermedad mitocondrial en adultos.
- Una única mutación de ADN mitocondrial – m.3243A> G - puede dar lugar a varios fenotipos sindrómicos diferentes
- PERO TAMBIÉN diferentes mutaciones en ADNmt pueden dar como resultado el mismo fenotipo sindrómico.
Además por ser actualmente la forma común de presentación la multisistémica Y NO LA SINDRÓMICA
APROXIMACIÓN ACTUAL AL DIAGNÓSTICO GENÉTICO DE APCIENTES CON SOSPECHA DE ENFERMEDAD DEL ADN MITOCONDRIAL
PRIMERO REALIZAR
Estudio de deleción única / duplicación
- Que no se detectan fácilmente mediante análisis de secuencia
- Las deleciones únicas representan una cuarta parte de todos los pacientes adultos con enfermedad relacionada con el ADNmt.
NO CONFUNDIR con las deleciones múltiples de ADNmt que son el resultado de defectos en los genes nucleares, principales responsables del mantenimiento de ADNmt o el metabolismo de los nucleósidos y siguen patrones de herencia mendeliana.
- Deleciones que varían en tamaño de 1,1 a 10 kb
- Las dos deleciones principales asociadas con enfermedades mitocondriales son la deleción común de 4977 pb y las deleciones de ∼7,4 kb
- Las duplicaciones rara vez ocurren con deleciones, pero pueden ocurrir solas.
TÉCNICA
En muestra de biopsia muscular: PCR de amplio rango para la detección de deleción única.
En leucocitos de sangre periférica: Amplificación de sonda dependiente de ligación múltiple (MLPA).
SEGUNDO
Estrategias DE SECUENCIACION empleadas en el diagnóstico genético de la enfermedad mitocondrial
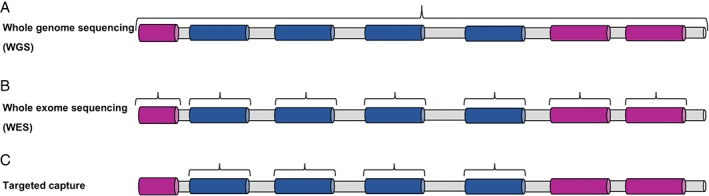
(A) WGS (secuenciación del genoma completo) analiza todas las regiones codificantes y no codificantes del genoma. (B) WES (secuenciación de todo el exoma) se dirige solo a los exones codificantes más los límites inmediatos entre intrón y exón. (C) Secuenciación dirigida a unos genes facilita la secuenciación de una región genómica predeterminada o una lista de genes de enfermedad candidatos. Las regiones no codificantes / intrónicas están sombreadas en gris, los exones de los genes candidatos están sombreados en azul y los exones de los genes no candidatos están sombreados en rosa.
PROF. DR. FERNANDO GALAN