Fernando Galán Galán
Profesor Titular de Medicina
Especialista en Medicina Interna
Experto en Miopatía Mitocondrial del Adulto
Fibromialgía y Síndrome de Fatiga crónica
BLOG
DIAGNÓSTICO DE LA OSTEOPOROSIS: LA DENSIDAD MINERAL ÓSEA NO LO ES TODO. 2021
La osteoporosis se define como un trastorno esquelético sistémico progresivo caracterizado por:
- baja densidad mineral ósea (DMO),
- deterioro de la microarquitectura del tejido óseo y
- Susceptibilidad a fracturas.
La reducción de la masa esquelética se debe a un desequilibrio entre la resorción ósea y la formación de hueso; el aumento de la resorción ósea o la disminución de la formación ósea pueden provocar osteoporosis.
- Los 2 factores más importantes que contribuyen al desarrollo de la osteoporosis son el envejecimiento y la pérdida de la función gonadal.
- La pérdida ósea en las mujeres se acelera rápidamente durante los primeros años posteriores a la menopausia
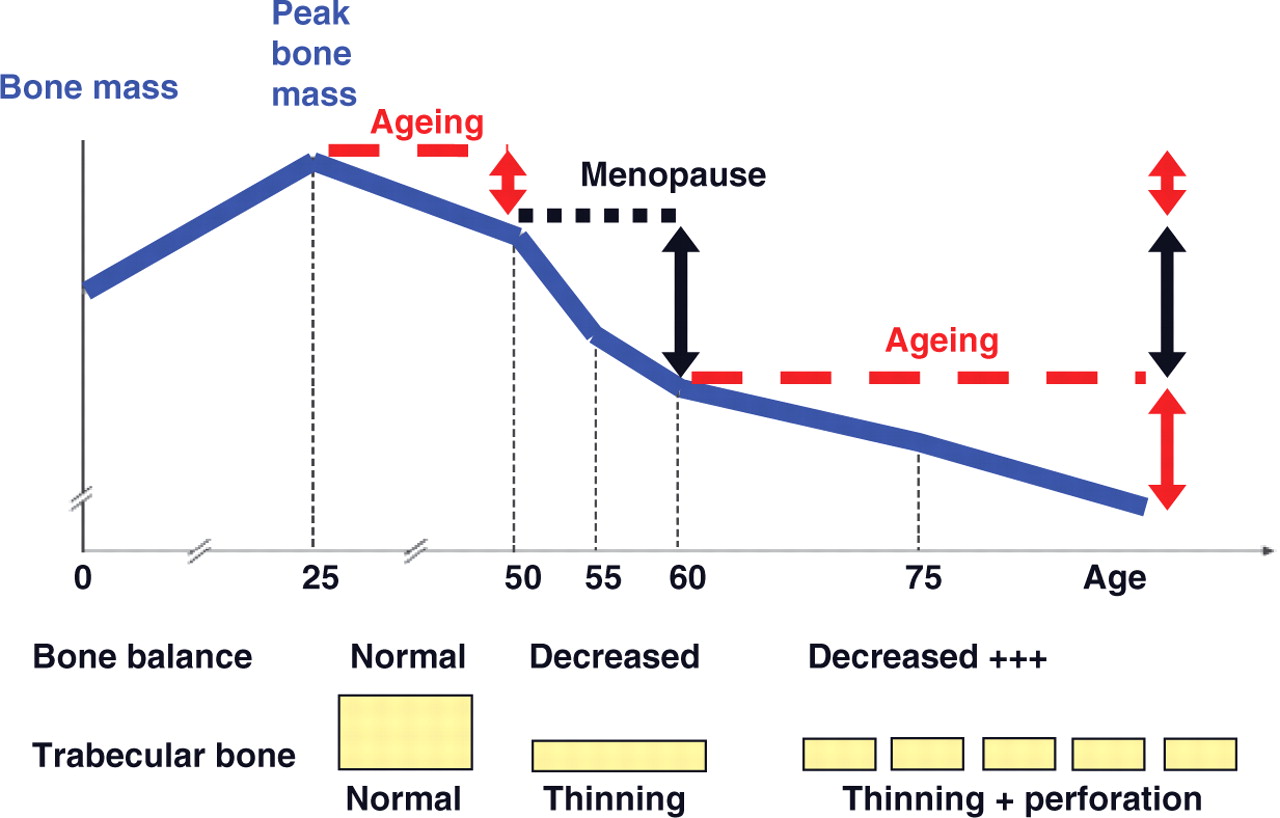
Pérdida ósea relacionada con la menopausia y la edad.
El problema es que la osteoporosis puede NO causar ningún síntoma, por lo que las personas generalmente no saben que tienen la afección hasta que se fracturan un hueso inesperadamente.
Las consecuencias a evitar son LAS FRACTURAS ÓSEAS
Las fracturas óseas, especialmente en la columna o la cadera, son las complicaciones más graves de la osteoporosis. Las fracturas de cadera a menudo son causadas por una caída y pueden resultar en discapacidad e incluso un mayor riesgo de muerte durante el primer año después de la lesión. Además, la mitad de las personas que se fracturan la cadera nunca recuperan la capacidad de caminar sin ayuda y una cuarta parte necesita cuidados a largo plazo.
En algunos casos, las fracturas de la columna pueden ocurrir incluso si no se ha caído. Los huesos que forman la columna vertebral (vértebras) pueden debilitarse hasta el punto de colapsar, lo que puede provocar dolor de espalda, pérdida de altura y una postura encorvada hacia adelante.
La absorciometría de rayos X de energía dual (DXA) puede detectar la pérdida de densidad mineral ósea antes de que pueda identificarse en la radiografía esquelética habitual, lo que permite diagnosticar la osteoporosis en mujeres posmenopáusicas y hombres mayores antes de que surjan fracturas clínicas. Sin embargo, cuando se usa DXA fuera de estas poblaciones o si el cuadro clínico NO coincide con las puntuaciones T informadas, pueden surgir errores al interpretar los resultados y determinar la necesidad de terapia farmacéutica.
PUNTOS CLAVES
- Si bien la DXA es la prueba estándar de oro para medir la densidad ósea, pero el juicio clínico debe tener prioridad, si los resultados contradicen la información clínica.
- Las puntuaciones T (T score) NO son indicadores fiables del riesgo de fractura en mujeres premenopáusicas, hombres más jóvenes y niños; se deben utilizar puntuaciones Z para estas poblaciones.
- Ahora se entiende que la resistencia ósea depende de factores además de la densidad mineral ósea, lo que a veces causa discordancia entre los resultados de la DXA y el verdadero riesgo de fractura.
- La herramienta de evaluación del riesgo de fracturas incorpora factores clínicos y puede ayudar a guiar las decisiones de tratamiento.
LO QUE DXA HACE BIEN
La DXA, desarrollada originalmente para evaluar el riesgo de fracturas en mujeres posmenopáusicas, es la prueba estándar de oro para diagnosticar la osteoporosis y controlar su tratamiento. Puede detectar deficiencias pequeñas pero clínicamente relevantes en la masa ósea años antes de que sean evidentes en las radiografías clínicas estándar, lo que permite a los médicos intervenir temprano para prevenir fracturas.
Puntuación T (T score)
La DXA mide la DMO del área (es decir, el contenido mineral óseo dividido por el área ósea escaneada) en la columna, la cadera o el antebrazo. El riesgo de fractura por fragilidad se basa en un valor calculado llamado T-score, que es la desviación estándar de la medición de un paciente de la media de una población de referencia joven y sana. Los valores y su significado son los siguientes:
- -2,5 o menos: mayor riesgo de fractura, diagnóstico de osteoporosis y necesidad de tratamiento farmacéutico
- -2,5 a 1,0: riesgo de fractura intermedio, diagnóstico de osteopenia (el enfoque terapéutico puede ser incierto)
- Por encima de 1.0: riesgo de fractura más bajo, diagnosticado como normal (por lo general, no hay preocupación inmediata por la terapia con medicamentos).
Como evaluación del riesgo de fractura, las puntuaciones T son aplicables solo a mujeres posmenopáusicas y hombres mayores no tratados.
- Una vez que ha comenzado la terapia con medicamentos, las puntuaciones T, NO reflejan con precisión el riesgo.
- Las mediciones de densidad ósea NO son un método eficaz para monitorear la respuesta al tratamiento porque los cambios en la densidad ósea pueden no detectarse hasta por 2 años.
Con la amplia disponibilidad de la DXA, los médicos a menudo la utilizan para investigar las preocupaciones sobre el esqueleto en poblaciones distintas de las mujeres posmenopáusicas, incluidos hombres, mujeres premenopáusicas, niños, adolescentes y adultos jóvenes de ambos sexos. Dicho uso conlleva desafíos a la hora de interpretar los resultados de la DXA.
Los avances científicos han dado lugar a una comprensión más compleja de las relaciones entre el riesgo de fractura, la resistencia ósea y la densidad ósea.
- Las puntaciones T, NO siempre se correlacionan con el riesgo de fractura o incluso con el historial de fractura del paciente y, por lo tanto, pueden malinterpretarse y dar lugar a recomendaciones de tratamiento inadecuadas.
- Una puntuación T NO debe determinar únicamente el diagnóstico y el tratamiento, y los datos clínicos deben modificar adecuadamente la interpretación de los resultados.
Los ensayos de fármacos revelan esta complejidad
Los medicamentos para la osteoporosis producen un espectro de cambios en la densidad ósea vertebral.
Un metaanálisis de 2019 que incluyó 38 ensayos de fármacos aleatorizados y 19 fármacos antirresortivos y anabólicos encontró una fuerte correlación entre las mejoras en la DMO y una mayor reducción en las tasas de fracturas vertebrales y de cadera, lo que tranquilizó a los médicos sobre la utilidad de la DXA para monitorear el tratamiento.
- Sin embargo, los efectos de los fármacos sobre la densidad ósea explicaron sólo del 48% al 63% de la reducción de las fracturas en la cadera y la columna.
Han surgido rarezas en análisis post hoc de ensayos clínicos que han llevado a nuevas nociones de resistencia ósea.
Observaciones que contribuyen a una nueva comprensión de la densidad y la fuerza óseas
- El tratamiento con diferentes clases de fármacos antirresortivos condujo a una reducción similar de la fractura vertebral a pesar de diferentes magnitudes de cambio en la densidad ósea.
- La tasa de fracturas tempranas mejoró con la terapia con risedronato a pesar de que no se observaron cambios en la densidad ósea.
- Las dosis altas y bajas de teriparatida condujeron a tasas similares de reducción de fracturas vertebrales pero diferentes aumentos en la densidad ósea.
- El fluoruro de sodio en dosis grandes para tratar la osteoporosis provocó más fracturas a pesar del aumento de la densidad ósea.
- Se produjo una alta prevalencia de fracturas de bajo impacto a pesar de la densidad mineral ósea anormalmente elevada en 2 pacientes con osteopetrosis autosómica dominante.
- Los pacientes con diabetes tienen un mayor riesgo de fracturas a pesar de la densidad ósea normal.
- Los pacientes con hiperparatiroidismo presentan discordancia entre las tasas de fractura y la densidad ósea central y periférica.
- El riesgo de fractura con glucocorticoides es independiente de la densidad mineral ósea y se correlaciona mejor con las medidas de microarquitectura ósea.
- Más de la mitad de las mujeres mayores con incidentes de fractura de cadera no tenían un diagnóstico de osteoporosis hasta 5 años antes.
En los primeros ensayos pivotales, diferentes fármacos aumentaron la DMO espinal anualmente en diferentes cantidades, mientras que condujeron a incidencias similares de fractura vertebral clínica o radiológica después de 3 años de terapia:
- calcitonina (DMO aumentó 1.1%; reducción de fractura 33%),
- risedronato (DMO aumentó 3.0- 3,9%; reducción de fracturas 41-49%). Algunos estudios de risedronato encontraron que la reducción de fracturas surgió dentro de los 6 a 12 meses de tratamiento sin cambios medibles en la densidad ósea, lo que sugiere que otros factores juegan un papel.
- raloxifeno (DMO aumentó 2,6%; reducción de fracturas 30-50%) y
- alendronato (DMO aumentó 3,2-5,7%; reducción de fracturas 30-48%).
Las nuevas tecnologías dirigidas a la microarquitectura ósea pueden algún día mejorar el análisis de riesgos.
Nuestra comprensión de la absorciometría de rayos X de energía dual (DXA) está evolucionando a medida que surge nueva información sobre las cualidades esqueléticas que contribuyen a la resistencia ósea, además de la densidad mineral ósea (DMO).
- Algunas de estas características NO son detectables mediante análisis DXA.
Por lo tanto, la dependencia excesiva de los resultados de la DXA, en particular para las poblaciones de pacientes para las que la prueba no fue diseñada, puede conducir a decisiones clínicas deficientes.
LA RESISTENCIA DEL HUESO DEPENDE DE MÁS COSAS QUE LA DENSIDAD MINERAL DEL HUESO
La DXA mide la cantidad de energía de rayos X que pasa a través del hueso y la correlaciona con la cantidad de mineral presente. En teoría, más mineral en el hueso (es decir, mayor densidad) indica una mayor fuerza ósea y resistencia a las fracturas, mientras que menos mineral indica un hueso más débil que es más propenso a fracturarse. Grandes estudios poblacionales realizados en el desarrollo de DXA respaldaron estas correlaciones en mujeres posmenopáusicas. Esto llevó a que el sistema de puntuación T se convirtiera en la norma para diagnosticar la osteoporosis y el alto riesgo de fracturas y para determinar la necesidad de tratamiento.
Pero nuestra comprensión de la relación entre la fuerza esquelética y la densidad ósea ha evolucionado. Ahora se reconoce que la calidad ósea depende no solo de la densidad, sino también de las características esqueléticas que NO se miden con DXA, incluido el tamaño y la geometría del hueso, la microarquitectura de los compartimentos trabeculares y corticales, el recambio celular (que refleja la actividad metabólica) y la composición de la matriz proteica mineralizada

La microarquitectura se ha convertido en un principio central de la visión cambiante de la fuerza ósea. La estructura tridimensional de placas óseas entrelazadas, análoga a las vigas de los edificios, confiere una resistencia intrínseca a la fractura. El aumento de las actividades osteoclásticas y la disminución de las actividades osteoblásticas en la osteoporosis producen una red arquitectónica degradada que se debilita y es susceptible a fracturas.
La osteoporosis es una enfermedad sistémica definida como una reducción de la masa ósea asociada con una arquitectura ósea deteriorada:
- interrupción de la continuidad trabecular por perforación trabecular, lo que resulta en una conectividad reducida de la estructura ósea trabecular, mayor fragilidad ósea y mayor riesgo de fractura;
- y se produce un adelgazamiento y un aumento de la porosidad de las cortezas, con la conversión de las trabéculas en forma de placa normales en estructuras en forma de varilla más delgadas.
Estos cambios son el resultado de la combinación del aumento de la actividad osteoclástica y la función reducida de los osteoblastos que caracteriza a la osteoporosis posmenopáusica.
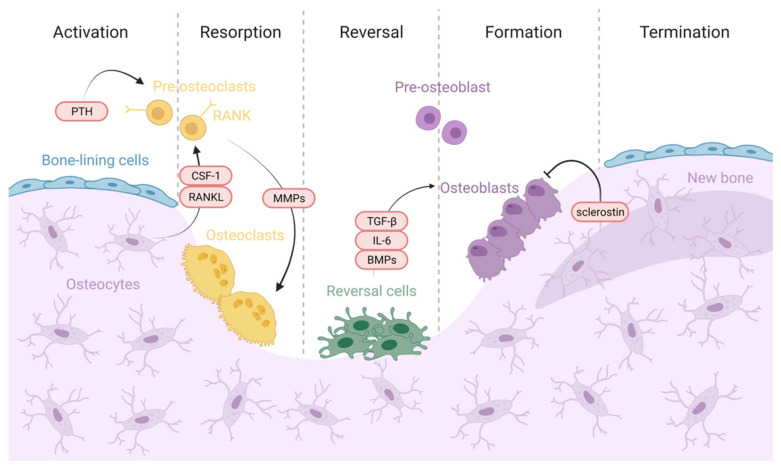
Proceso de remodelación ósea. Activación: el hueso en estado de reposo detecta una señal de inicio desencadenada por fuerzas mecánicas, microdaños u hormonas sistémicas como la PTH A continuación, se induce la apoptosis de los osteocitos liberando factores osteoclastogénicos como el factor estimulante de colonias 1 (CSF-1) y el activador del receptor del ligando NF-κB (RANKL) que favorecen el reclutamiento y la activación del precursor de los osteoclastos. Resorción: los osteoblastos secretan citocinas y metaloproteinasas de matriz (MMP) para exponer los sitios de adhesión de RGD para facilitar la unión de los osteoclastos . Los osteoclastos disuelven la matriz mineralizada y la matriz orgánica ósea mediante la secreción de iones de hidrógeno y MMP, respectivamente . Reversión: las células de "reversión" eliminan la matriz de colágeno no mineralizado y depositan una "línea de cemento" de matriz mineralizada no colágena para mejorar la adhesión osteoblástica. Las células de inversión y los osteoclastos son responsables de enviar y recibir señales de acoplamiento, incluidos factores derivados de la matriz ósea como TGF-ꞵ, BMP e IL-6 . Luego, los osteoclastos son reemplazados por células de linaje de osteoblastos, lo que promueve el inicio de la formación ósea . Formación: los progenitores de osteoblastos reemplazan a los osteoclastos en las lagunas de reabsorción, se diferencian y comienzan la formación de hueso nuevo. Los osteoblastos continúan formando hueso nuevo hasta que vuelven a las células del revestimiento óseo que cubren la superficie del hueso. Terminación: Los osteocitos producen esclerostina, suprimiendo la diferenciación de osteoblastos y la formación de hueso. Luego, el entorno de la superficie ósea en reposo se restablece y se conserva hasta que se inicia de nuevo el ciclo de remodelación ósea. A Multidisciplinary Journey towards Bone Tissue Engineering 2021
Nuevas medidas de calidad y resistencia ósea
La tecnología de imagenología reciente ha ayudado a dilucidar los factores relacionados con la resistencia ósea. Se puede visualizar la microarquitectura del hueso y se pueden emplear protocolos de ingeniería para medir su resistencia. La tomografía computarizada cuantitativa periférica de alta resolución es una herramienta importante que produce imágenes tridimensionales de los compartimentos cortical y trabecular en el hueso apendicular, con resistencia analizada por análisis de elementos finitos.
- Sin embargo, esta tecnología generalmente se limita a los centros de investigación.
La puntuación del hueso trabecular utiliza un programa patentado para analizar información (es decir, la textura de escala de grises) en imágenes DXA para generar datos sobre la integridad del marco trabecular de las vértebras y, en segundo lugar, el riesgo de fractura. Los puntajes altos se correlacionan con una estructura intacta, no degradada con bajo riesgo, y los puntajes bajos se correlacionan con una estructura degradada y un alto riesgo.
- Aunque está disponible clínicamente, este programa aún no se ha generalizado.
INCORPORACIÓN DEL RIESGO CLÍNICO EN LA INTERPRETACIÓN DE DXA
Sin duda, la DXA es una herramienta útil para detectar la pérdida ósea temprana, pero los resultados deben moderarse con el juicio clínico. Las fracturas pueden ocurrir en un paciente con cualquier puntuación T, de manera análoga a la ocurrencia de un accidente cerebrovascular con presión arterial normal y eventos coronarios con niveles normales de lípidos. Es posible que se pierda la oportunidad de prevenir la pérdida ósea si un médico espera a que la densidad ósea de un paciente de alto riesgo alcance el umbral de osteoporosis de puntuación T.
Debido a que el análisis DXA estándar NO puede detectar cambios microestructurales, los médicos deben recurrir a otros enfoques para generar información sobre la calidad del esqueleto. En la práctica diaria, la historia clínica aporta datos importantes sobre los factores de riesgo, que en el sentido más amplio revelan información sobre la microarquitectura .
Factores clínicos de riesgo de fracturas
- Edad avanzada
- Bajo peso corporal y tamaño esquelético.
- Antecedentes familiares de osteoporosis o fracturas.
- Historia del paciente de fracturas
- Historia de caídas y desequilibrio.
- Antecedentes de enfermedades del adulto que comprometen los huesos: trastornos endocrinos, enfermedad intestinal, trastornos nutricionales, enfermedad renal.
- Antecedentes de uso de fármacos tóxicos para los huesos: glucocorticoides, antiestrógenos, antiandrógenos, agentes oncológicos
- Historia de enfermedad infantil que afecta el desarrollo esquelético
- Historia de problemas puberales: pubertad retrasada o ausente, amenorrea, anorexia nerviosa
- Historial de estilo de vida nocivo: alcohol, tabaco, inactividad.
- Incremento de los marcadores de recambio óseo
Calculadoras de riesgo clínico
La mayoría de los factores de riesgo clínico son variables binarias y la ponderación de su importancia está sujeta a interpretación, lo que a menudo hace que la experiencia del médico sea el factor determinante para estimar el riesgo. Las calculadoras de riesgo de fractura proporcionan una puntuación numérica objetiva para ayudar a guiar las decisiones.
De las 13 calculadoras de riesgo en uso, la herramienta de evaluación de riesgo de fractura (FRAX), Garvan y QFracture se han estudiado ampliamente.
- Son especialmente útiles cuando el acceso a DXA es limitado.
- Varían en el número de variables utilizadas en sus análisis.
- Su uso puede estar restringido a poblaciones geográficas específicas y no cuantifican factores en los cálculos como la duración y la cantidad de uso de glucocorticoides y la gravedad de las enfermedades secundarias.
- Están destinados a personas mayores y tienen una aplicabilidad limitada a pacientes jóvenes. Pueden subestimar el riesgo real.
Evaluar a los pacientes mediante DXA y FRAX
Estas siguen siendo las principales herramientas para evaluar el riesgo de fracturas.
- Sin embargo, sus resultados no deben considerarse absolutos.
- El médico, no la tecnología, es el árbitro final para diagnosticar la enfermedad.
La edad es un factor de riesgo crítico
Hace más de tres décadas, un estudio fundamental descubrió que la edad es un factor de riesgo importante de fractura, independientemente de la densidad ósea. Con el envejecimiento, las tasas de fractura aumentan exponencialmente a medida que disminuye la densidad ósea. Es menos probable que se produzcan fracturas en personas más jóvenes que en personas mayores, incluso con mediciones de densidad ósea similares. Los datos clínicos muestran que esta paradoja refleja la degradación de la microarquitectura dependiente de la edad. Como resultado, un paciente joven con densidad ósea baja puede no tener un riesgo alto de fractura a menos que estén presentes otros factores clínicos, y un paciente mayor con puntuaciones T no osteoporóticas podría tener un riesgo alto de fractura debido a otros factores de riesgo clínicos.
La edad es una variable en todas las calculadoras de riesgo clínico. FRAX utiliza la edad para generar umbrales de intervención para fracturas con o sin densidad ósea medida.
FRAX: la calculadora de riesgos más importante
FRAX tiene aplicabilidad y validación mundial en diferentes países. Sus cálculos pueden ser parte de un informe DXA, o los médicos pueden usar herramientas basadas en la web para ejecutar los cálculos. Proporciona un umbral de intervención para el análisis de decisiones.
Aunque FRAX se usa en todo el mundo, los estudios sugieren que sus umbrales pueden no ser universales, pero lo ideal es que se generen en función de la población geográfica específica del paciente.
- Muchos países utilizan las pautas de la Fundación Nacional de Osteoporosis de EE. el riesgo es al menos del 3% o el riesgo de fractura por osteoporosis mayor al menos el 20%.
FRAX puede proporcionar una evaluación del riesgo de fractura solo a partir de la edad, pero es más precisa si se agrega la DMO de cadera, con o sin factores de riesgo asociados, como fractura previa, fractura de cadera de los padres, estado actual de tabaquismo, uso de glucocorticoides, artritis reumatoide, osteoporosis secundaria y consumo de alcohol. (> 3 unidades por día).
Estas son variables dicotómicas en la calculadora, pero los médicos a menudo consideran aspectos cuantitativos (p. Ej., Cantidad y duración del uso de glucocorticoides, gravedad y tipo de osteoporosis secundaria) en su evaluación y decisión.
FRAX ahora permite el uso de datos de puntuación de hueso trabecular para ayudar a calcular los umbrales de intervención para fracturas osteoporóticas mayores y de cadera. Mejora significativamente la predicción del riesgo en pacientes con resultados de FRAX que de otro modo serían dudosos.
¿MARCADORES DE REMODELACIÓN ÓSEA AÑADEN INFORMACIÓN?
Los marcadores bioquímicos del recambio óseo no deben usarse de forma rutinaria para el diagnóstico de osteoporosis en la práctica general. La medición de marcadores debe limitarse a la práctica especializada y puede ser útil para el seguimiento de la adherencia al tratamiento y en la evaluación de causas secundarias de pérdida ósea.
Para uso clínico, la International Osteoporosis Foundation propuso
- el telopéptido C del colágeno tipo 1 (CTX) como marcador bioquímico de la resorción ósea y
- el propéptido N del procolágeno tipo 1 (P1NP) como marcador de la formación ósea,
- pero no son herramientas de diagnóstico para la osteoporosis y no sustituyen al análisis DXA.
Estos marcadores reflejan el metabolismo o el recambio óseo. Durante la menopausia y en la osteoporosis no tratada, los marcadores óseos pueden aumentar e indicar un alto recambio esquelético.
- Según los resultados de las pruebas, las mujeres menopáusicas pueden agruparse como "perdedoras de huesos" rápidas o lentas.
- Los estudios de cohortes muestran que la pérdida ósea es mayor y el riesgo de fractura es mayor a medida que aumentan estos biomarcadores.
- Sin embargo, para un paciente individual, es difícil cuantificar esta relación y los marcadores no predicen con precisión la pérdida ósea o su magnitud.
Pero en la práctica clínica, estos marcadores pueden ayudar a controlar la adherencia del paciente y la eficacia del fármaco:
Los fármacos antirresortivos reducen los niveles de CTX y P1NP. El cambio menos significativo (es decir, la diferencia más pequeña entre las mediciones sucesivas que probablemente sea un cambio real en lugar de una casualidad) varía con el tipo de ensayo utilizado.
- Dependiendo del ensayo, el cambio menos significativo en CTX es del 50% al 54% y el cambio menos significativo en P1NP es del 23% al 29%.
- La respuesta clínica esperada es una reducción de 74% a 75% en CTX y una reducción de 51% a 54% en P1NP.
La variabilidad de medición individual ocurre a partir de ritmos circadianos, patrones de comidas y técnicas de laboratorio. La consistencia en la adquisición de muestras (p. Ej., Muestras en ayunas temprano en la mañana) y el uso del mismo laboratorio de análisis ayudan a minimizar la variabilidad.
¿CUÁNDO USAR LA PUNTUACIÓN T SCORE O LA PUNTUACIÓN Z SCORE?
Puntuación T-score:
- En mujeres posmenopáusicas y hombres de 50 años o más
- T-score NO se puede aplicar a las mujeres premenopáusicas sanas, a hombres menores de 50 años, y a los niños.
Puntuación Z-score:
- En mujeres premenopáusicas sanas, hombres menores de 50 años y niños
- Z-score -2.0 o menos ( ej. -2.3) se define como "debajo del rango esperado para la edad"
- Z-score arriba de -2.0 (ej. -1.8) está "dentro del rango esperado para la edad”
CONCLUSIONES
- El problema de la osteoporosis es que puede NO causar ningún síntoma, por lo que las personas generalmente no saben que tienen la afección, hasta que se fracturan un hueso inesperadamente. Y precisamente el objetivo es el diagnostico precoz y la prevención de LAS FRACTURAS ÓSEAS
- Si bien la DXA es la prueba estándar de oro para medir la densidad ósea, pero el juicio clínico debe tener prioridad, si los resultados contradicen la información clínica.
- Las puntuaciones T (T score) NO son indicadores fiables del riesgo de fractura en mujeres premenopáusicas, hombres más jóvenes y niños; se deben utilizar puntuaciones Z para estas poblaciones.
- Como evaluación del riesgo de fractura, las puntuaciones T son aplicables solo a mujeres posmenopáusicas y hombres mayores no tratados.
- Ahora se entiende que la resistencia ósea depende de factores además de la densidad mineral ósea, lo que a veces causa discordancia entre los resultados de la DXA y el verdadero riesgo de fractura.
- La herramienta de evaluación del riesgo de fracturas incorpora factores clínicos y puede ayudar a guiar las decisiones de tratamiento.
REFERENCIAS
- Susan Williams, MS, RD, MD, CCD, FACP, FACE, Leila Khan, MD and Angelo A. Licata, MD, PhD, FACP, FACE. DXA and clinical challenges of fracture risk assessment in primary care. Cleveland Clinic Journal of Medicine November 2021, 88; 615-622; DOI: https://doi.org/10.3949/ccjm.88a.20199
- Brandi Maria Luisa. Microarchitecture, the key to bone quality. Rheumatology, 2009, 48, Issue supp4;3–8. https://doi.org/10.1093/rheumatology/kep273
- van den Bergh, J., Szulc, P., Cheung, A. et al. The clinical application of high-resolution peripheral computed tomography (HR-pQCT) in adults: state of the art and future directions. Osteoporos Int 2021,32, 1465–1485. https://doi.org/10.1007/s00198-021-05999-z
PROF. DR. FERNANDO GALAN




