El medicamento Kaftrio® (ivacaftor / tezacaftor / elexacaftor) en combinación con ivacaftor será dispensado en hospitales públicos a partir del 1 de diciembre 2021, para personas con fibrosis quística que tengan 12 o más años con al menos una copia de la mutación F508 del en el gen CFTR, independientemente de su otra mutación.
Una limitación importante de estos nuevos tratamientos farmacéuticos para pacientes con FQ, como los moduladores CFTR, son los costes excesivos cuando llegan al mercado
Coste en España: 9.819€ = 117.828€ por paciente y año. FINANCIADO POR LA SEGURIDAD SOCIAL
La mutación F508del representa aproximadamente el 70% de los alelos de FIBROSIS QUÍSTICA (FQ) y otras mutaciones de CFTR son responsables de los restantes.
INTRUDUCCIÓN
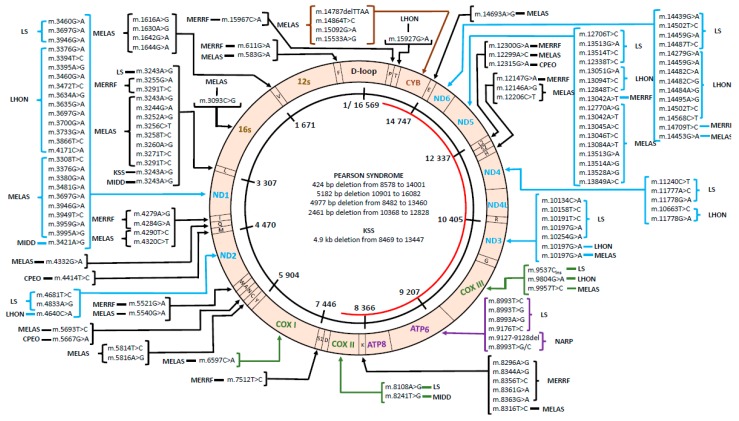
La fibrosis quística (FQ) es la más común entre las enfermedades genéticas raras y afecta a más de 70.000 personas en todo el mundo. La FQ se caracteriza por un canal de cloruro disfuncional, denominado regulador de la conductancia de la fibrosis quística (CFTR), que conduce a la producción de una capa de moco espesa y viscosa. Afecta a diferentes órganos del cuerpo, sobre todo pulmones y páncreas. Es precisamente la afectación pulmonar de la enfermedad, la que les provoca una gran dificultad para respirar. Que obstruye los pulmones de los pacientes con FQ y atrapa a los patógenos, lo que provoca infecciones crónicas e inflamación y, en última instancia, daño pulmonar. Los pacientes con homocigosis p.Phe508del suelen tener una función pulmonar más deficiente y mayores tasas de mortalidad por año que otros grupos.
- La incidencia en España afecta a uno de cada 4.000 nacimientos, mientras que una de cada 35 personas son portadoras sanas de la enfermedad.
- Se desconoce la prevalencia exacta en Europa, pero se estima que se sitúa entre 1/8.000 y 1/10.000 personas.
- Fibrosis quística: Número de casos vivos de Fibrosis quística a 31 de diciembre 2018 = 178 . Registro Estatal de Enfermedades Raras 2010-2018
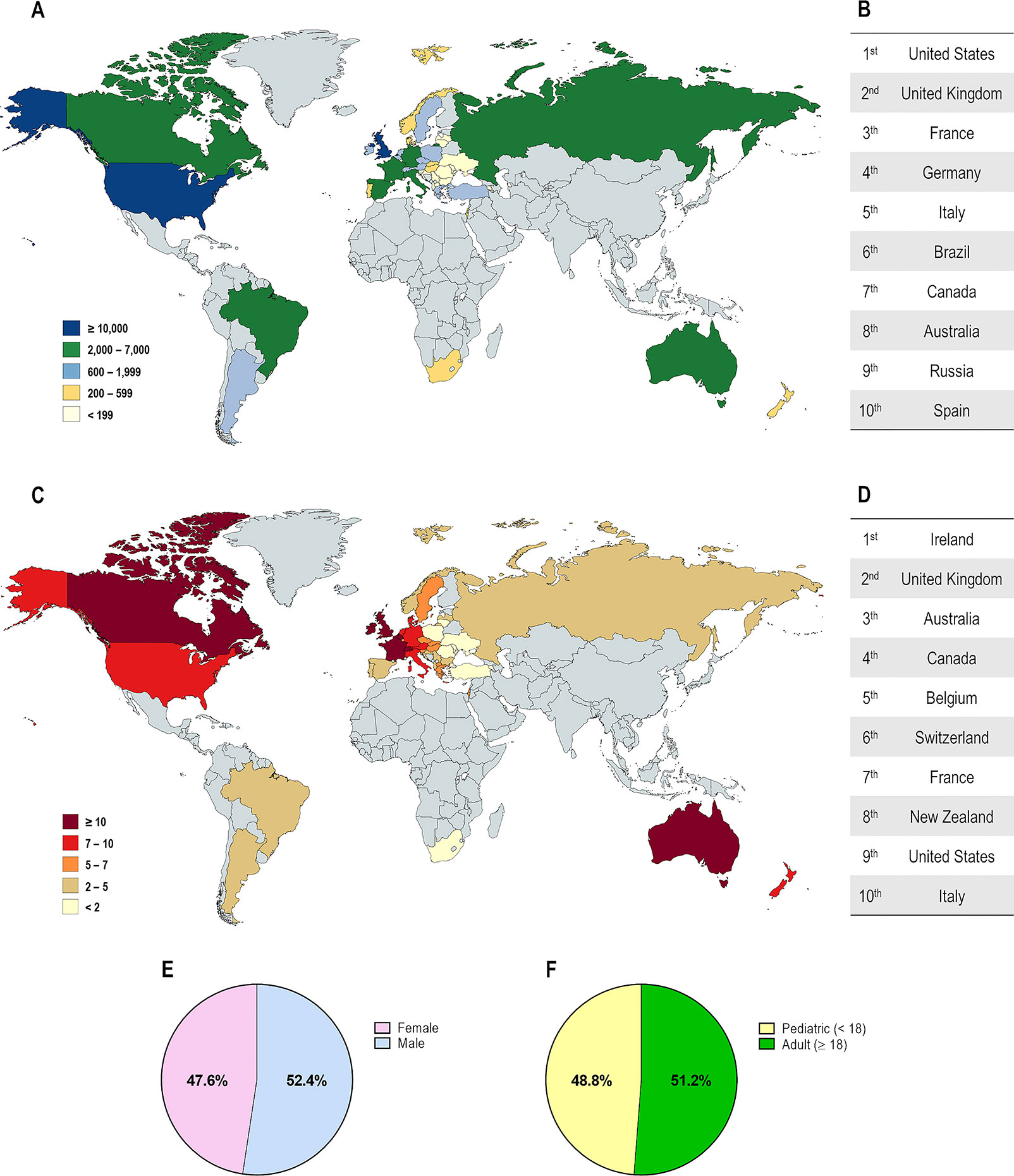
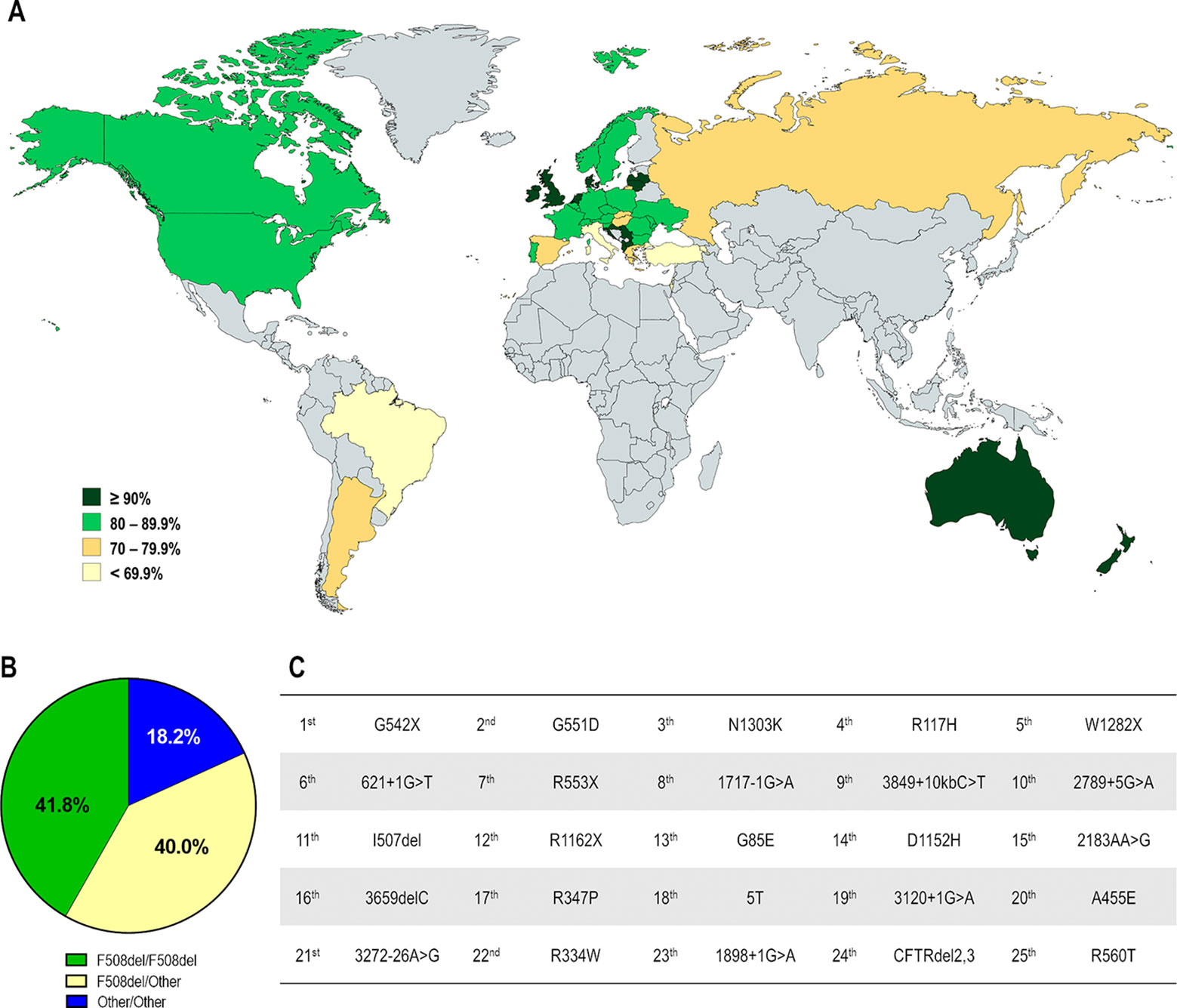
Demografía de pacientes con fibrosis quística en diferentes países. (A) Distribución según el total de pacientes registrados. (B) Top 10 de países con mayor número de pacientes registrados. (C) Distribución según la prevalencia estimada de pacientes por 100.000 habitantes. (D) Top 10 de países con mayor número de pacientes por cada 100.000 habitantes. Distribución global por género (E) y por edad
Demografía de las mutaciones del regulador de conductancia transmembrana de la FQ (CFTR) en diferentes países. (A) Distribución según el porcentaje de pacientes portadores de la mutación F508del en al menos un alelo. (B) Distribución global por genotipo de FQ: F508del-homocigoto, F508del-heterocigoto y portador de mutaciones distintas de F508del en ambos alelos. (C) Las 25 mutaciones de CFTR distintas de F508del más prevalentes considerando toda la población con FQ.
DIAGNÓSTICO DE LA FIBROSIS QUÍSTICA
CRIBADO NEONATAL
En nuestro país, los programas de cribado neonatal (PCN) son los responsables del diagnóstico del 70-80% de nuevos casos, siendo el principal método de diagnóstico. Su implantación ha permitido un diagnóstico más temprano, permitiendo un tratamiento precoz, y mejorando tanto la calidad de vida como el pronóstico de la enfermedad.
- El estudio se inicia con la determinación de tripsina imnunorreactiva (TIR) mediante inmunofluorescencia en una muestra de sangre obtenida del talón del recién nacido. La técnica tiene una sensibilidad de 85,7% y una especificidad de 99,6%. Dependiendo del PCN, el estudio de un TIR elevado continúa con un análisis genético o un test de sudor.
Tras el estudio genético de un neonato con TIR elevada son posibles tres resultados:
- Si se encuentran dos mutaciones causantes de FQ (diagnóstico positivo), se debe realizar el test del sudor y el estudio de segregación para comprobar que cada una de las dos mutaciones procede de uno de sus progenitores.
- Si se encuentra una sola mutación, también debe realizarse el test del sudor para determinar si se trata de un portador o un posible afecto de FQ, en cuyo caso se ampliaría el estudio molecular.
- Si no se encuentran mutaciones y el test del sudor es normal, el estudio se considera finalizado.
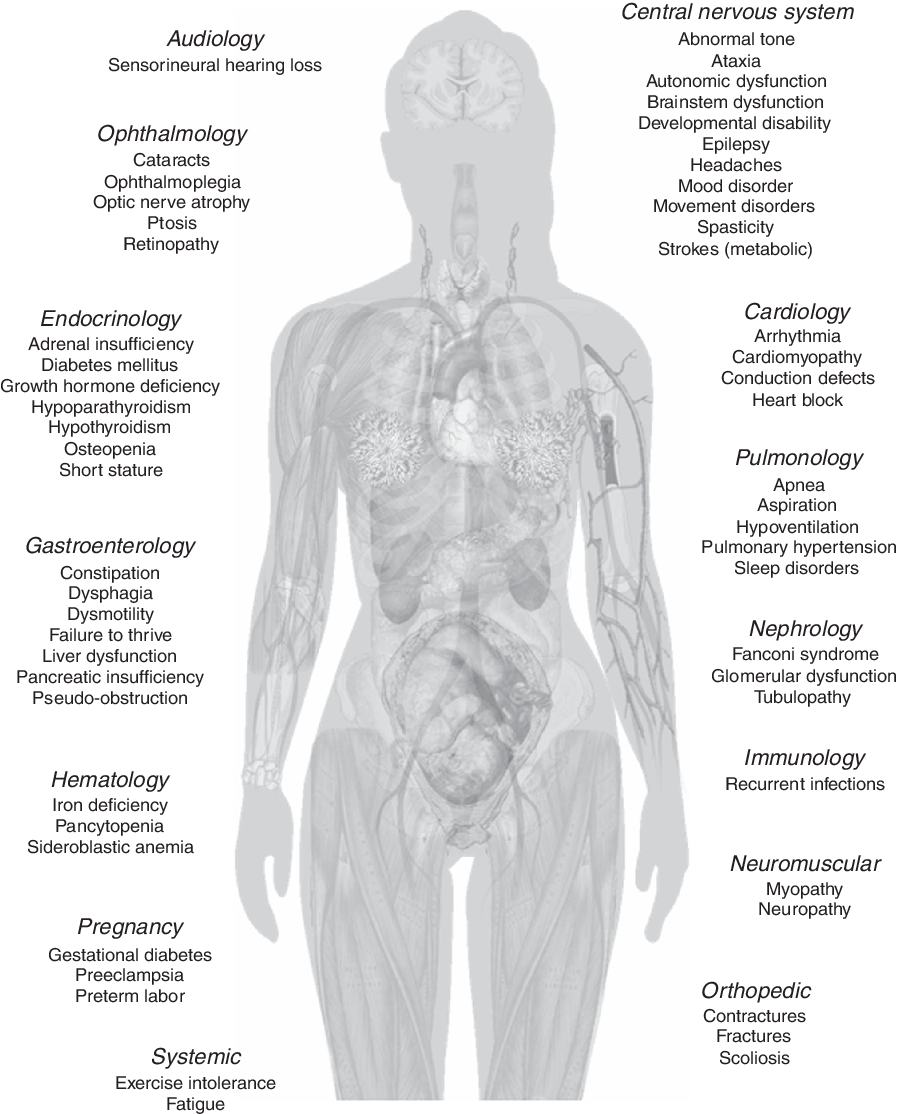
MANIFESTACIONES CLÍNICAS
Sinupatía o bronconeumopatía crónica manifestada por:
- Colonización/infección persistente por microorganismos encontrados habitualmente enpacientes con FQ: Staphylococcus aureus, Haemophilus influenzae, Pseudomonasaeruginosa, Stenotrophomonas maltophilia y Burkholderia cepacia
- Tos y producción de esputo purulento de forma crónica
- Alteraciones persistentes en radiografía de tórax: bronquiectasias, atelectasias, infiltrados, hiperinsuflación
- Obstrucción de las vías aéreas manifestada por sibilancias y atrapamiento aéreo
- Poliposis nasal o alteraciones de los senos paranasales
- Acropaquias o dedos en palillos de tambor: agrandamiento indoloro e insensible de las falanges terminales de los dedos de las manos y de los pies
Alteraciones gastrointestinales y nutricionales:
- Intestinales: íleo meconial, síndrome de obstrucción intestinal distal, prolapso rectal
- Pancreáticas: insuficiencia pancreática exocrina, pancreatitis aguda recurrente, pancreatitis crónica, alteraciones pancreáticas detectadas por técnicas de imagen
- Hepáticas: ictericia neonatal prolongada, hepatopatía crónica sugerida por el cuadro clínico por características histológicas de cirrosis biliar focal o multilobulillar.
- Nutricionales: retraso de crecimiento (malnutrición proteico-calórica), hipoproteinemia y edema, complicaciones secundarias a déficit de vitaminas liposolubles.
Síndromes pierde-sal:
- Pérdida aguda de sal
- Alcalosis metabólica crónica
Alteraciones urogenitales en el varón:
- Azoospermia obstructiva
Criterios para el diagnóstico de FQ:
Que concurra una o más de las siguientes circunstancias:
- Uno o más rasgos fenotípicos característicos de FQ
- Historia de FQ en hermano o primo hermano
- Cribado neonatal positivo
Junto con evidencia de:
- Test del sudor ≥ 60 mmol/L en dos o más ocasiones
- Dos mutaciones causantes de FQ
- Diferencia de potencial nasal, es decir, diferencia de potencia eléctrica anormal de un extremo a otro de la superficie del epitelio nasal
TRATAMIENTO DE LA FIBROSIS QUÍSTICA
Los pilares básicos del tratamiento del paciente con FQ son:
- la rehabilitación respiratoria junto con otros tratamientos que mejoran el aclaramiento mucociliar,
- el tratamiento de la infección e inflamación crónica de la vía respiratoria,
- la terapia de reemplazo con enzimas pancreáticos en aquellos pacientes con insuficiencia pancreática
- y el soporte nutricional adecuado.
Además de estos pilares básicos, estaría la detección precoz y tratamiento de las enfermedades asociadas a la FQ, como: diabetes, osteopenia y/o hepatopatía
En la actualidad, todos los pacientes en tratamiento con un modulador de CFTR deben continuar con los tratamientos actuales según las indicaciones de su clínica de FQ (p. ej., enzimas pancreáticas, mucolíticos, antibióticos inhalados, broncodilatadores, agentes antiinflamatorios, fisioterapia respiratoria). Deben continuar siendo monitoreados trimestralmente según los estándares de atención de la FQ.
Los estudios clínicos en curso determinarán si se puede interrumpir algún tratamiento para la FQ una vez que los pacientes reciban CFTR terapia moduladora
 .
.
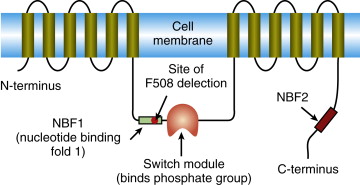
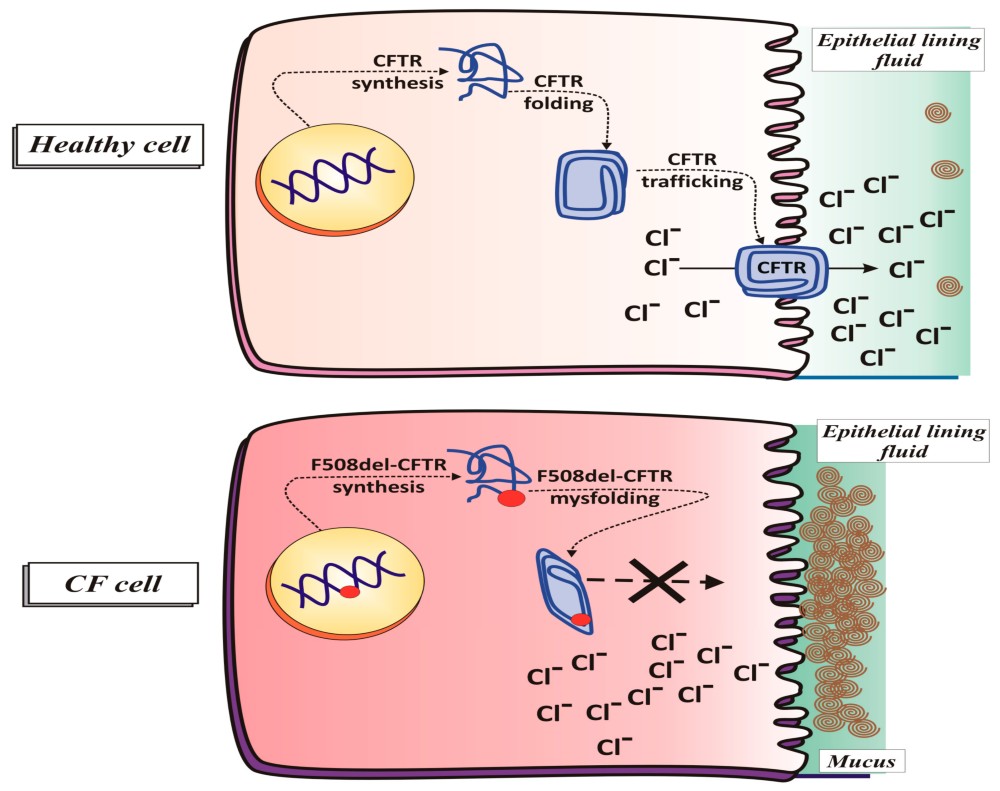
Actividad de la Proteína reguladora de la conductancia transmembrana de la fibrosis quística (CFTR) en la célula. En una CÉLULA SALUDABLE, una inserción correcta de CFTR normal en la membrana permite el movimiento de iones a través del epitelio de las vías respiratorias; en una CÉLULA CF, el transporte de iones Cl- no ocurre debido a la incapacidad de la proteína del canal CFTR mutada (F508del-) para alcanzar la membrana plasmática.
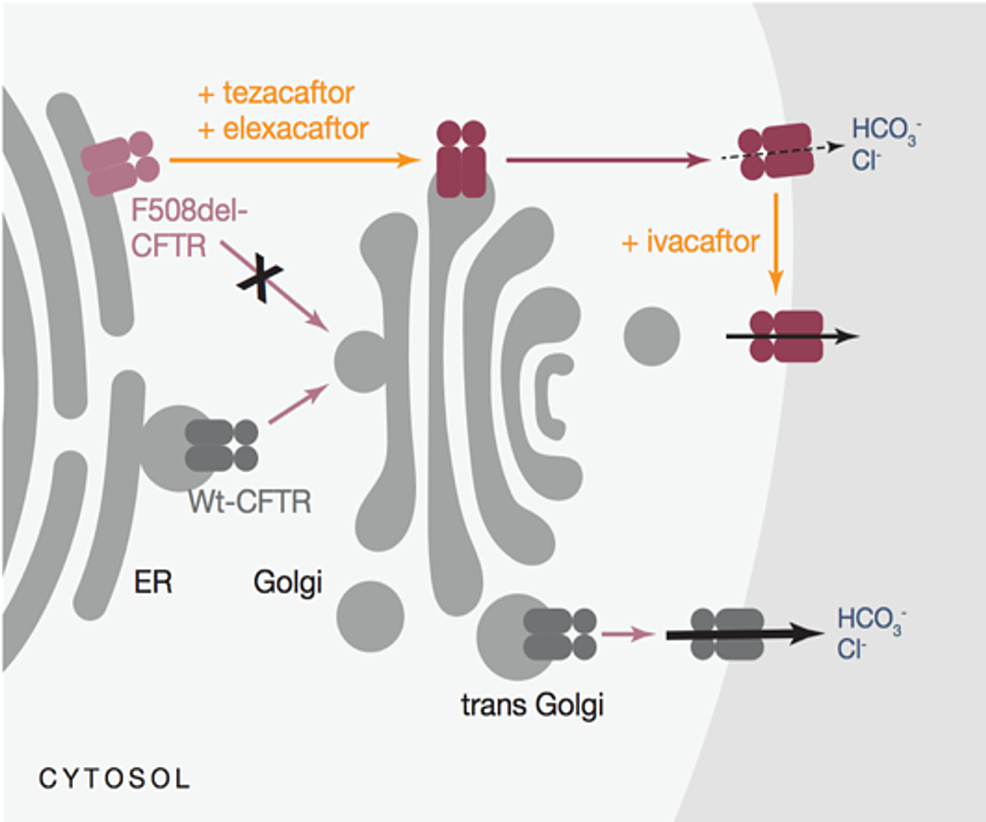
Muestra el efecto de los correctores CFTR (elexacaftor y tezacaftor) y el potenciador del canal CFTR (ivacaftor) en el aumento del transporte de iones de cloruro y sodio
Mecanismo de acción
El ivacaftor funciona como un potenciador de la proteína CFTR para mutaciones de activación comunes, lo que permite un aumento en el flujo de iones de cloruro.
Tezacaftor funciona como un corrector para facilitar el plegamiento y la presentación de la proteína CFTR madura en la superficie celular, mejorando la función de CFTR para Mutación F508del.
Elexacaftor también es un corrector de CFTR que funciona en un sitio de unión alternativo al de tezacaftor en la proteína CFTR para facilitar aún más la funcionalidad de la proteína CFTR en la superficie celular. Cuando se usaron en combinación, elexacaftor, tezacaftor e ivacaftor demostraron un aumento en la función de la proteína CFTR mutada F508del en la superficie celular, lo que resultó en un aumento del transporte de iones de cloruro.
Dosis recomendada para pacientes de 6 años o más
|
Edad |
Dosis de la mañana |
Dosis de la noche |
|
6 a <12 años que pesan <30 kg |
2 comprimidos de 37,5 mg de ivacaftor/25 mg de tezacaftor/50 mg de elexacaftor |
1 comprimido de 75 mg de ivacaftor |
|
6 a <12 años que pesan ≥30 kg |
2 comprimidos de 75 mg de ivacaftor/50 mg de tezacaftor/100 mg de elexacaftor |
1 comprimido de 150 mg de ivacaftor |
|
≥12 años |
2 comprimidos de 75 mg de ivacaftor/50 mg de tezacaftor/100 mg de elexacaftor |
1 comprimido de 150 mg de ivacaftor |
Tome los comprimidos de la mañana y de la noche con un intervalo de unas 12 horas
Medicamento en forma farmaceútica de tipo comprimido recubierto con película, se administra por vía oral. 56 comprimidos
Kaftrio 37,5 mg/25 mg/50 mg comprimidos recubiertos con película
Kaftrio 75 mg/50 mg/100 mg comprimidos recubiertos con película
Ivacaftor
- Kalydeco 75 mg comprimidos recubiertos con película
- Kalydeco 150 mg comprimidos recubiertos con película
El tratamiento con Kaftrio más ivacaftor dio lugar a un aumento medio del 10,2 % en el porcentaje del volumen espiratorio forzado en un segundo (ppFEV1) previsto en la semana 24, con mejoras observadas tan pronto como 2 semanas después del inicio.
De momento en España están aprobados y financiados por el SNS los medicamentos siguientes:
Indicado para personas con FQ de 12 meses de edad y mayores, con al menos una de nueve mutaciones específicas: G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N y S549R.
También para la mutación R117H en personas mayores de 18 años
Principio activo: Ivacaftor
Indicado para personas con FQ de 6 a 11 años con dos copias de la mutación F508del
Principios activos: Ivacaftor / Lumacaftor
Indicado para personas con FQ a partir de 6 años con dos copias de la mutación F508del, así como personas con una sola copia F508del más una de las siguientes 14 mutaciones de función residual: P67L, R117C, L206W, R352Q, A455E, D579G, 711 + 3A → G, S945L, S977F, R1070W, D1152H, 2789 + 5G → A, 3272-26A → G, y 3849 + 10kbC → T)
Principios activos: Ivacaftor / Tezacafto
Indicado para personas con FQ de 12 años en adelante con una utación F508del y una mutación de función mínima (MF) o dos mutaciones F508del
Principios activos: Ivacaftor / Tezacaftor / Elexacaftor
En pacientes con enfermedad avanzada, elexacaftor-tezacaftor-ivacaftor se asocia con una rápida mejoría clínica, lo que a menudo lleva a suspender la indicación de trasplante pulmonar.
CONCLUSIONES
- El medicamento Kaftrio® (ivacaftor / tezacaftor / elexacaftor) en combinación con ivacaftor será dispensado en Hospitales públicos a partir del 1 de diciembre 2021, para personas con fibrosis quística que tengan 12 o más años con al menos una copia de la mutación F508 del en el gen CFTR, independientemente de su otra mutación.
- Una limitación importante de estos nuevos tratamientos farmacéuticos para pacientes con FQ, como los moduladores CFTR, son los costes excesivos cuando llegan al mercado. España: 9.819€ = 117.828€ por paciente y año. FINANCIADO POR LA SEGURIDAD SOCIAL
- Fibrosis quística en España: Número de casos vivos de Fibrosis quística a 31 de diciembre 2018 = 2.178 . Registro Estatal de Enfermedades Raras 2010-2018. En el Top 10 de países con mayor número de pacientes registrados.
- En pacientes con enfermedad avanzada, elexacaftor-tezacaftor-ivacaftor se asocia con una rápida mejoría clínica, lo que a menudo lleva a suspender la indicación de trasplante pulmonar.
REFERENCIAS
- Lopes-Pacheco M. CFTR Modulators: The Changing Face of Cystic Fibrosis in the Era of Precision Medicine. Front Pharmacol. 2020 Feb 21;10:1662. doi: 10.3389/fphar.2019.01662. PMID: 32153386; PMCID: PMC7046560.
- Sala V, Cnudde SJ, Murabito A, Massarotti A, Hirsch E, Ghigo A. Therapeutic peptides for the treatment of cystic fibrosis: Challenges and perspectives. Eur J Med Chem. 2021 Mar 5;213:113191. doi: 10.1016/j.ejmech.2021.113191. Epub 2021 Jan 16. PMID: 33493828.
- Gramegna A, Contarini M, Bindo F, Aliberti S, Blasi F. Elexacaftor-tezacaftor-ivacaftor: The new paradigm to treat people with cystic fibrosis with at least one p.Phe508del mutation. Curr Opin Pharmacol. 2021 Apr;57:81-88. doi: 10.1016/j.coph.2021.01.001.
- Burgel PR, Durieu I, Chiron R, Ramel S, Danner-Boucher I, Prevotat A, Grenet D, Marguet C, Reynaud-Gaubert M, Macey J, Mely L, Fanton A, Quetant S, Lemonnier L, Paillasseur JL, Da Silva J, Martin C; French Cystic Fibrosis Reference Network Study Group. Rapid Improvement after Starting Elexacaftor-Tezacaftor-Ivacaftor in Patients with Cystic Fibrosis and Advanced Pulmonary Disease. Am J Respir Crit Care Med. 2021 Jul 1;204(1):64-73. doi: 10.1164/rccm.202011-4153OC. PMID: 33600738.
PROF. DR. FERNANDO GALAN