Fernando Galán Galán
Profesor Titular de Medicina
Especialista en Medicina Interna
Experto en Miopatía Mitocondrial del Adulto
Fibromialgía y Síndrome de Fatiga crónica
BLOG
DATOS ESPERANZADORES DE LOS RESULTADOS PROVISIONALES EN FASE 1, DE LA VACUNA DE ARNm ( (ARNm-1273) CONTRA EL SARS-CoV-2
Hitos clave en el desarrollo de la vacuna mRNA-1273 contra el nuevo coronavirus.
- 11 de enero. Las autoridades chinas compartieron la secuencia genética del nuevo coronavirus.
- 13 de enero. El equipo de investigación de enfermedades infecciosas de NIH y Moderna finalizó la secuencia para mRNA-1273. Moderna movilizada hacia la fabricación clínica. El NIAID, parte de los NIH, reveló su intención de llevar a cabo un estudio de fase 1 utilizando ARNm-1273 en respuesta a la amenaza del coronavirus. La fabricación de este lote fue financiada por la Coalition for Epidemic Preparedness Innovations (CEPI).
- 7 de febrero. Se completó el primer lote clínico de ARNm-1273, un total de 25 días desde la selección de la secuencia hasta la fabricación de la vacuna. El lote luego pasó a las pruebas analíticas para su liberación.
- 24 de febrero. Moderna envió el primer lote clínico de ARNm-1273 al NIH para su uso en su estudio clínico de fase 1.
- 4 de marzo. La FDA completó su revisión de la solicitud de IND presentada por el NIH para mRNA-1273 y permitió que el estudio procediera a ensayos clínicos.
- 16 de marzo. El NIH anunció que se dosificó al primer participante en su estudio de fase 1 del ARNm-1273, un total de 63 días desde la selección de la secuencia hasta la primera dosificación en humanos.
- 23 de marzo. Si bien es probable que una vacuna disponible comercialmente no esté disponible durante al menos 12-18 meses, Moderna informó que es posible que, en caso de uso de emergencia, una vacuna esté disponible para algunas personas, posiblemente incluyendo profesionales de la salud, en el otoño de 2020. Moderna confirmó que está aumentando la capacidad de fabricación hacia la producción de millones de dosis por mes, en la forma potencial de viales individuales o multidosis.2
- 27 de marzo. El NIH anunció que la Universidad de Emory en Atlanta comenzaría a inscribir voluntarios adultos sanos de entre 18 y 55 años en el estudio de fase 1 dirigido por los NIH del ARNm-1273.
- 16 de abril. BARDA otorgó a Moderna hasta $ 483 millones para acelerar el desarrollo del ARNm-1273 para permitir la producción a gran escala en 2020 para una respuesta pandémica. El estudio de fase 1 dirigido por los NIH del ARNm-1273 completó la inscripción de tres cohortes de dosis (25 µg, 100 µg y 250 µg) y se amplió a seis cohortes adicionales: tres cohortes de adultos mayores (edades 56-70) y tres cohortes de adultos mayores (71 años o más).
- 27 de abril. Moderna presentó un IND a la FDA de EE. UU. Para el estudio de fase 2 del ARNm-1273.
- El 1 de mayo. Moderna y Lonza anunciaron una colaboración estratégica mundial con el objetivo de permitir la fabricación de hasta mil millones de dosis de ARNm-1273 por año.
- El 6 de mayo, Moderna informó que Anthony S. Fauci, M.D., Director de NIAID, participó en una entrevista con National Geographic, que describió su evaluación de los resultados de ciertas pruebas preclínicas relacionadas con el estudio clínico de fase 1 en curso de ARNm-1273.
- 12 de mayo. Moderna recibió la designación Fast Track de la FDA para mRNA-1273.
- 18 de mayo. Moderna anunció datos positivos positivos de la Fase 1 para ARNm-1273.
INTRODUCCIÓN
SARS-CoV-2 es un virus de ARN perteneciente a la familia de coronavirus, que recibe este nombre por la apariencia característica de las proteínas de su cubierta.
Presentación esquemática de la organización del genoma del SARS-CoV-2, los ARNm subgenómicos canónicos y la estructura del virión.
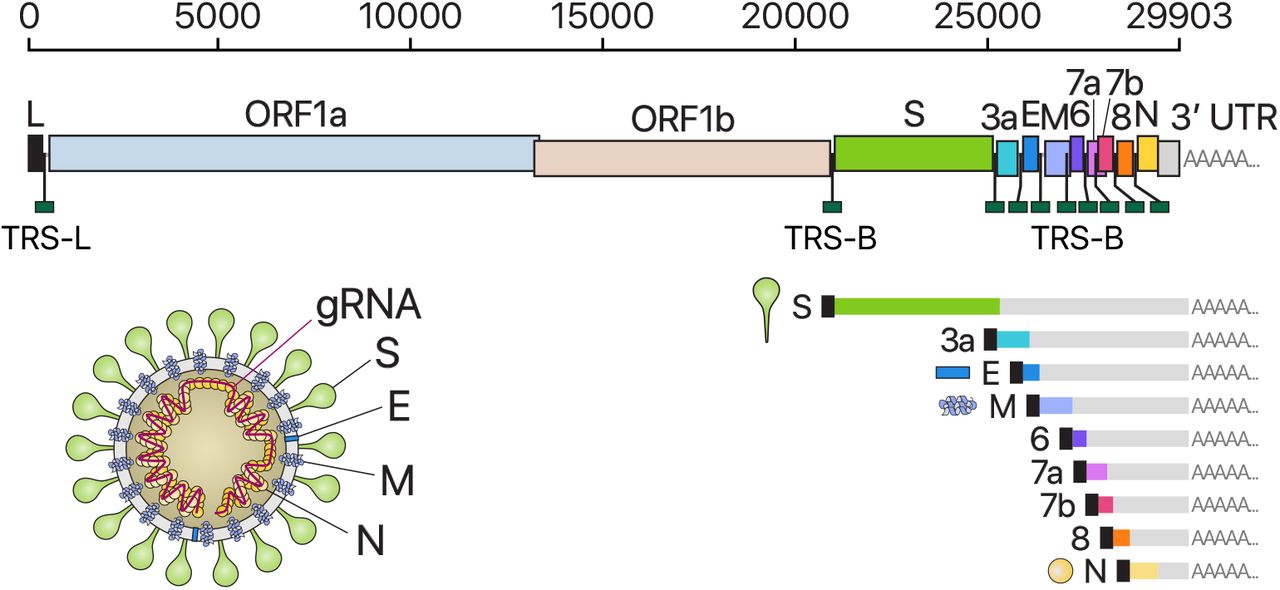
El ARN de longitud completa (29.903 nt) que también sirve como ARNm, se traducen ORF1a y ORF1b. Además del ARN genómico, se producen nueve ARN subgenómicos principales. Los tamaños de las cajas que representan pequeñas proteínas accesorias son más grandes que el tamaño real del ORF para una mejor visualización. El cuadro negro indica la secuencia líder. Su genoma contiene 29.903 nucleótidos que codifican para 9.860 aminoácidos.
El genoma del SARS-CoV codifica cuatro proteínas estructurales: proteínas de espiga (S), envoltura (E), membrana (M) y nucleocápside (N) y seis proteínas accesorias (3a, 6, 7a, 7b, 8 y 10)
Mecanismo de infección y entrada a las células del organismo
El primer paso de la infección por coronavirus SARS-CoV-2 es la entrada del virus en las células. Lo hace a través de la unión de una proteína de su superficie, la proteína S, con el receptor ACE-2 (enzima convertidora de angiotensina 2) de las células huésped.
La proteína S está formada por tres unidades idénticas organizadas en forma de círculo que encajan con el receptor ACE-2 como una llave y median la fusión de la cubierta membranosa del virus con la membrana de la célula que está siendo infectada. La unión entre la proteína S y el receptor ACE-2 marca el punto de destino del virus en el organismo, pero es la activación de la proteína S lo que abre las puertas de la célula al virus.
La activación de la proteína S está mediada la proteasa celular TMPRSS2, que suele localizarse cerca de ACE-2. TMPRSS2 corta la proteína S, lo que activa proteínas de la envoltura viral que favorecen la fusión con la membrana celular. De este modo, los virus entran en la célula rodeados de membrana celular, formando endosomas. En estas pequeñas bolsas celulares, se liberan catepsinas, otras proteínas que modifican de nuevo la proteína S, y proteasas que favorecen la liberación del ARN viral al citoplasma. Para este proceso son importantes las condiciones de pH en el interior de las vesículas.
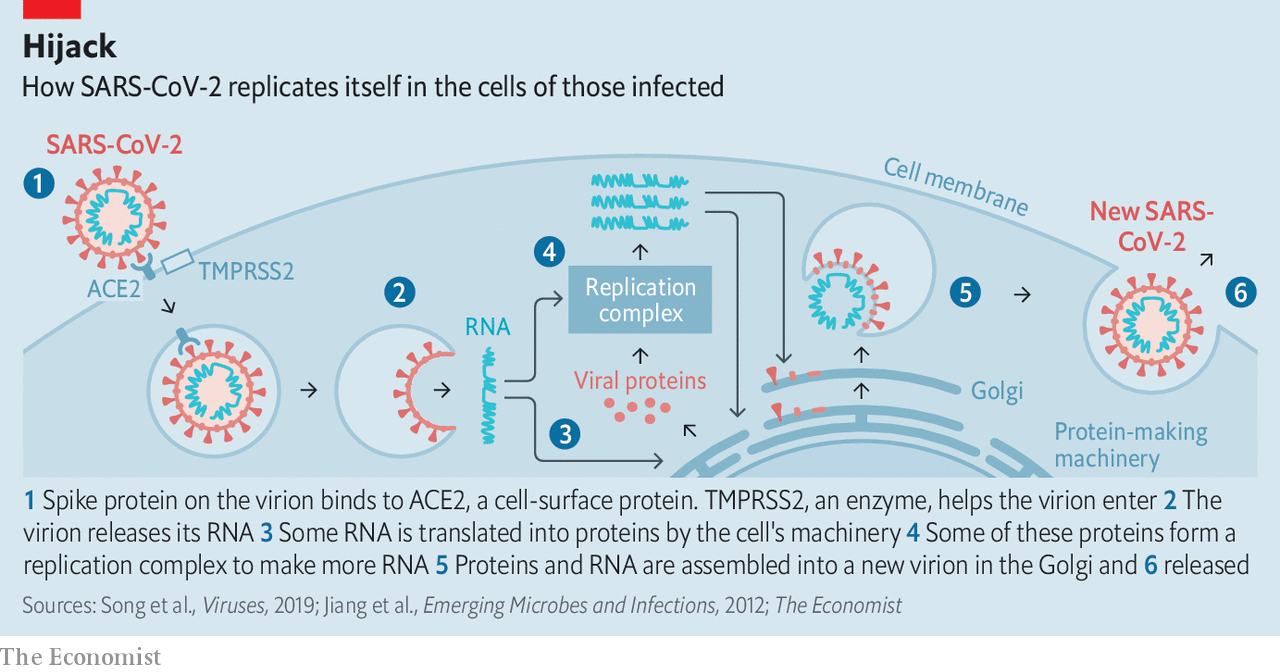
Al ser liberado, el ARN viral se traduce directamente a poliproteínas, que son procesadas en proteínas funcionales responsables de la replicación y transcripción del virus. Así, por una parte, se producen ARNs que son traducidos en proteínas estructurales del virus y por otra se generan ARNs genómicos que serán empaquetados en los nuevos viriones que se van formando. Por último, los viriones se liberan al exterior de la célula y pueden infectar otras células
El importante papel de la proteína S, el receptor ACE-2 y la proteasa TMPRSS2 en la entrada del virus a la célula ha hecho que estas moléculas se conviertan en moléculas clave para el desarrollo de tratamientos o vacunas.
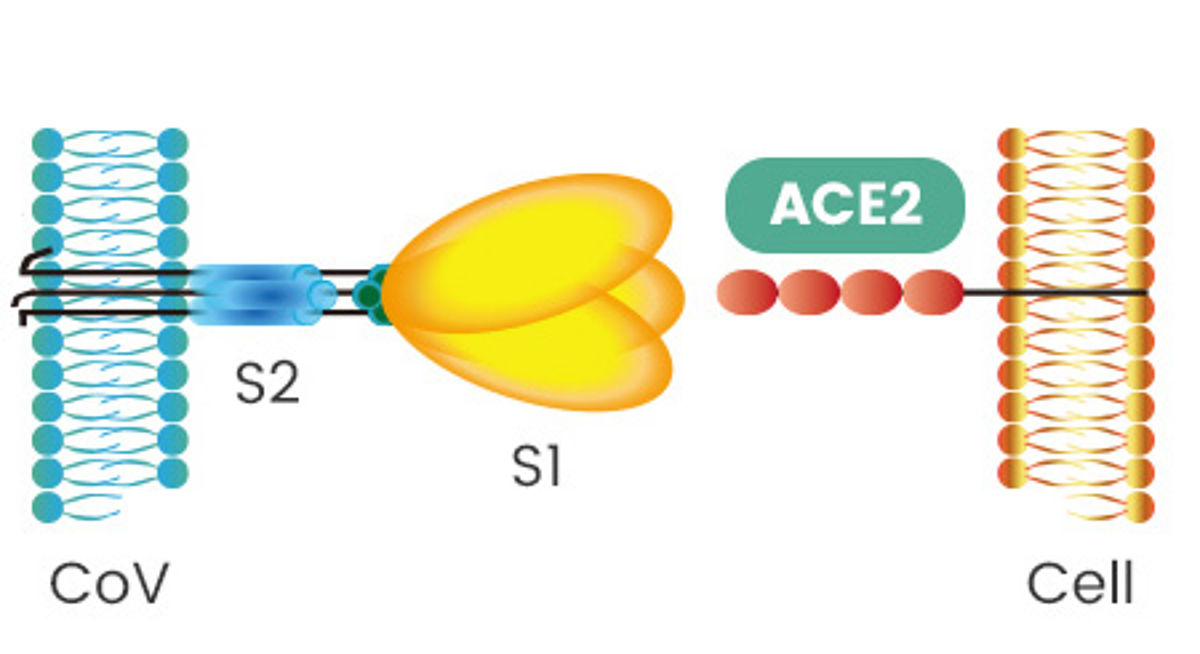
TMPRSS2 activa las proteínas S de SARS-CoV2 y se expresa en las células del epitelio respiratorio humano que también expresan el receptor de SARS-CoV, ACE2
VACUNAS BASADAS EN EL ARN MENSAJERO
Existen cuatro ventajas principales de seguridad y eficacia del uso de vacunas antivirales basadas en ARNm sobre los enfoques tradicionales.
- Primero, las vacunas antivirales basadas en ARNm minimizan el riesgo potencial de infección y mutagénesis inducida por inserción debido a la degradación natural del ARNm en el microambiente celular.
- En segundo lugar, la alta eficacia del inmunógeno debido a modificaciones estructurales de ARNm modificadas mejora su estabilidad y eficacia de traducción.
- En tercer lugar, la alta potencia de las vacunas basadas en ARNm capaces de generar inmunoglobulinas neutralizadoras antivirales potentes con solo una o dos inmunizaciones de dosis bajas puede inducir respuestas inmunes fuertes activando las células T CD8 + y CD4 + .
- Cuarto, la ingeniería de producción de ARNm facilita la producción a gran escala de suficientes dosis de vacunas requeridas para tratar poblaciones en masa. Todos estos factores hacen que la vacuna de ARNm sea más adecuada para una respuesta rápida a la pandemia emergente de COVID-19.
Las vacunas de ARN funcionan mediante la introducción de una secuencia de ARNm en las células del huésped. Este ARNm codifica un antígeno específico de la enfermedad. Una vez dentro de una célula, el ARNm ordena a la célula que produzca el antígeno, que es reconocido por el sistema inmunitario que produce un anticuerpo y/o una respuesta celular.
Esto imita el proceso por el cual ocurren las infecciones virales naturales, donde la información de los genomas virales se usa para producir proteínas virales dentro de una célula. Potencialmente, esto puede mejorar la respuesta inmune, incluidas las respuestas mejoradas de células B y T
La vacuna ARNm-1273 es una cadena sintética de ARNm encapsulada en nanopartículas lipídicas que codifica la proteína de espiga (S) estabilizada por prefusión. El ARNm se estabiliza para protegerlo de las enzimas que podrían descomponerlo.
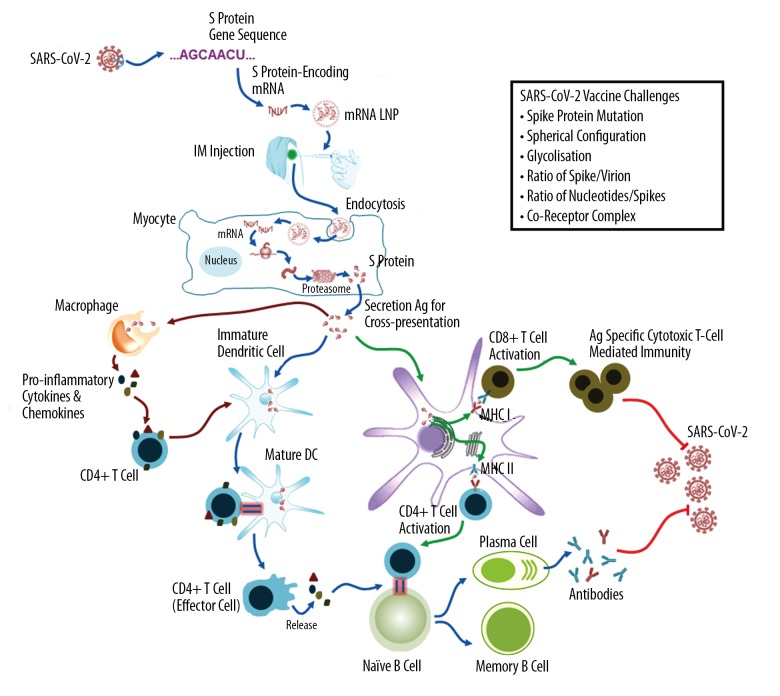
Diagrama esquemático de la vacuna ARNm-1273 cadena sintética de ARNm recombinante que codifica la proteína espiga (proteína S) del SARS-CoV-2 que ingresa a las células y se utiliza para producir proteínas antigénicas virales dentro de la célula.
Una vez inyectados en el músculo, los miocitos toman la nanopartícula lipídica (LNP) y luego liberan los ARNm en el citoplasma para su traducción en las proteínas S. Estas proteínas S sintetizadas endógenamente se secretarán para activar las respuestas inmunes humoral y celular.
Proteína S - proteína espiga; IM - intramuscular, LNP - nanopartícula lipídica; DC - célula dendrítica; MHC - complejo principal de histocompatibilidad; Ag - antígeno.

Diagrama de la estructura de la vacuna ARNm y modo de acción. ARNm formulado con nanopartículas lipídicas (LNP) con marco de lectura abierto de antígeno (magenta), flanqueado por regiones cortas no traducidas (amarillo), una tapa de 5 'm7G para iniciar la traducción (cian) y una cola de poliA de 3' (púrpura) para proteger la transcripción de la degradación. Al ingresar a la célula, el ARNm se libera del LNP y los ribosomas lo traducen en proteína Spike. Spike se exporta para el reconocimiento de anticuerpos y procesado por el inmunoproteosoma para el reconocimiento de células T.
Datos positivos de fase 1 provisional para su vacuna de ARNm (ARNm-1273) contra el nuevo coronavirus SARS-CoV-2 dirigido por el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID), parte de los Institutos Nacionales de Salud (NIH).
Los datos de inmunogenicidad están disponibles actualmente para:
- dosis de 25 µg y 100 µg (edades 18-55) después de dos dosis (día 43)
- dosis de 250 µg (edades 18-55) después de una dosis (día 29).
Se observaron aumentos de la inmunogenicidad dependientes de la dosis en los tres niveles de dosis - 25, 100 o 250 microgramos-, y entre la primera y segunda dosis de 25 µg y 100 µg.
Todos los 45 participantes de 18 a 55 años (n = 15 por cohorte) en los tres niveles de dosis - 25, 100 o 250 microgramos- se seroconvirtieron el día 15 después de una dosis única.
- En el día 43, dos semanas después de la segunda dosis, con dosis de 25 µg (n = 15), los niveles de anticuerpos estaban en los niveles observados en sueros convalecientes (muestras de sangre de personas que se han recuperado de COVID-19) analizadas en el mismo ensayo.
- En el día 43, la dosis de 100 µg (n = 10), los niveles de anticuerpos excedieron significativamente los niveles observados en sueros convalecientes. Las muestras aún no están disponibles para los participantes restantes.
En este momento, los datos de anticuerpos neutralizantes están disponibles solo para los primeros cuatro participantes en cada una de las cohortes (8 en total) de dosis de 25 µg y 100 µg.
- De acuerdo con los datos de anticuerpos, la vacunación con ARNm-1273 provocó anticuerpos neutralizantes en los ocho participantes, medidos por ensayos de neutralización por reducción de placa (PRNT) contra SARS-CoV-2 vivo. Los niveles de anticuerpos neutralizantes en el día 43 estaban en o por encima de los niveles generalmente observados en sueros convalecientes
Tolerancia y seguridad
El ARNm-1273 fue generalmente seguro y bien tolerado, con un perfil de seguridad consistente con el observado en estudios clínicos previos de vacunas de enfermedades infecciosas Moderna.
- La única incidencia de un evento adverso de grado 3 en las cohortes de dosis de 25 µg y 100 µg fue un solo participante de 100 µg que experimentó eritema grado 3 (enrojecimiento) alrededor del sitio de inyección.
- Hasta la fecha, los eventos adversos más notables se observaron en el nivel de dosis de 250 µg, que comprende tres participantes con síntomas sistémicos de grado 3 - fiebre, dolores musculares y dolores de cabeza -,solo después de la segunda dosis. Todos los eventos adversos han sido transitorios y de resolución automática. No se han informado eventos adversos de grado 4 o eventos adversos graves.
Los resultados preclínicos de un estudio de exposición viral en ratones realizados en colaboración con el NIAID y sus socios académicos también están disponibles.
- En este estudio, la vacunación con ARNm-1273 evitó la replicación viral en los pulmones de animales expuestos a SARS-CoV-2.
- Los títulos neutralizantes en los participantes de la fase 1 del ensayo clínico a las dosis de 25 µg y 100 µg fueron consistentes con los títulos neutralizantes que fueron protectores en el modelo de exposición a ratones.
Según los datos provisionales de la Fase 1, el estudio de Fase 2 dirigido por Moderna se modificará para estudiar dos niveles de dosis, 50 µg y 100 µg, con el objetivo de seleccionar una dosis para estudios posteriores. El estudio de fase 1 dirigido por el NIAID se está modificando para incluir una cohorte de nivel de dosis de 50 µg en cada uno de los tres grupos de edad.
Moderna anticipa que la dosis para el estudio de Fase 3 estará entre 25 µg y 100 µg y espera el inicio del ensayo de Fase 3 en julio, sujeto a la finalización del protocolo del ensayo clínico.
La compañía Moderna, con sede en Cambridge, Massachusetts, tiene un centro de fabricación de vacunas cerca en Norwood, y recientemente anunció una colaboración de 10 años con el fabricante de medicamentos por contrato suizo Lonza para fabricar hasta mil millones de dosis al año para distribución mundial, si la vacuna resulta exitosa
OPCIONES ACTUALES DE TRATAMIENTO
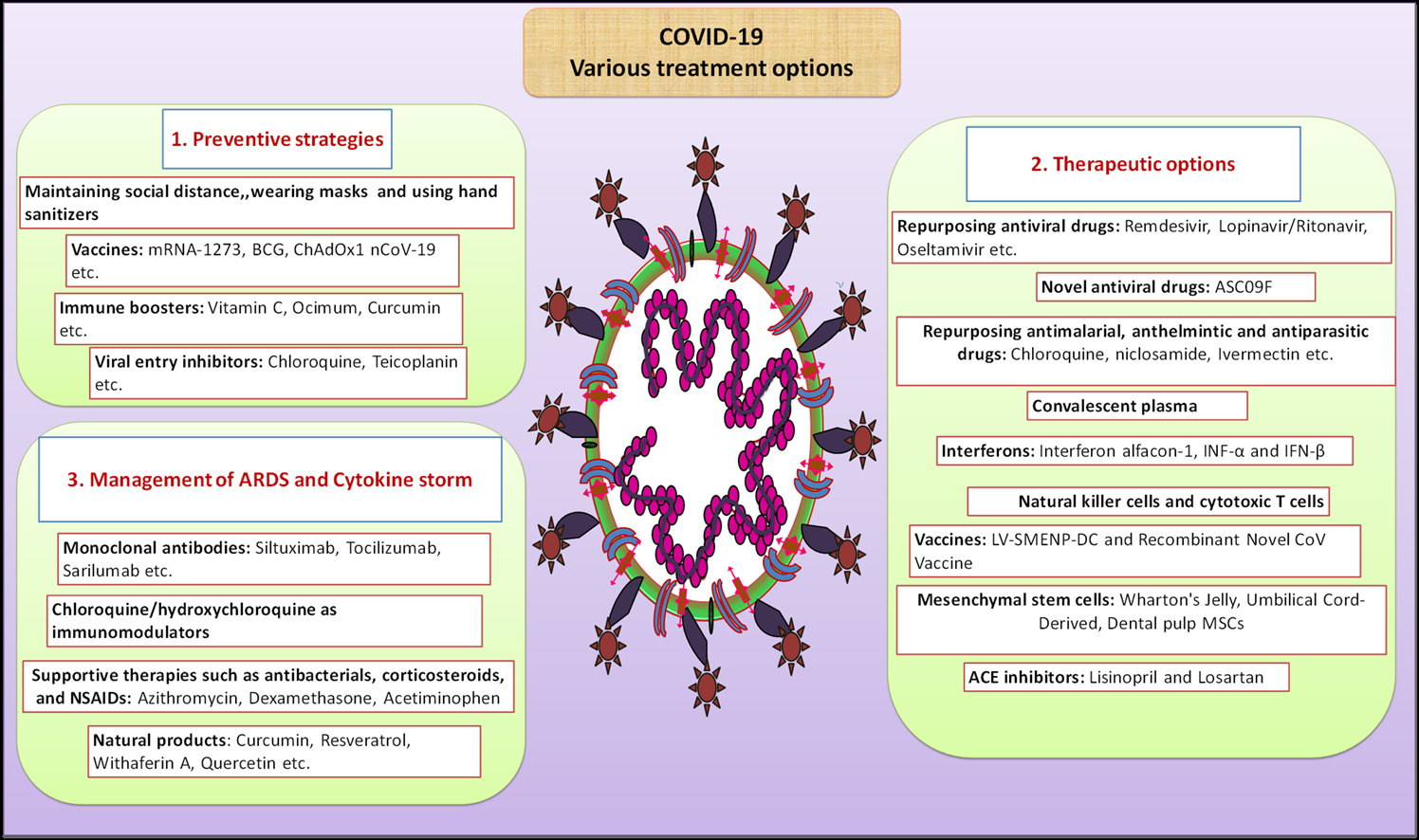
CONCLUSIONES
- El SARS-CoV-2 es un virus de ARN, con ARNm para las diferentes proteínas.
- La entrada SARS-CoV-2 en la célula, es a través de la unión de una proteína de su superficie, la proteína S, con el receptor ACE-2, pero es la activación de la proteína S - mediada por la proteasa celular TMPRSS2- la que abre las puertas de la célula al virus.
- La vacuna ARNm-1273 está formada por una cadena sintética de ARNm recombinante que codifica la proteína S (spike o espiga) del SARS-CoV-2, y al ingresar en las células se utiliza para producir proteínas antigénicas virales, que son reconocidas por el sistema inmunitario humoral y celular, montando le respuesta inmunitaria que aborta la infección.
- La vacuna ARNm-1273 en cantidades de 25 µg y 100 µg, administrada en dos dosis, producen similares o superiores niveles de anticuerpos neutralizantes a los observados en sueros de personas que se habían recuperado de COVID-19. Y aparecen a los 15 después de primera dosis.
REFERENCIA
- Fuzhou W, Kream RM , Stefano GB. An Evidence Based Perspective on mRNA-SARS-CoV-2 Vaccine Development. Med Sci Monit. 2020 May 5;26:e924700. doi: 10.12659/MSM.924700.
PROF. DR. FERNANDO GALAN




