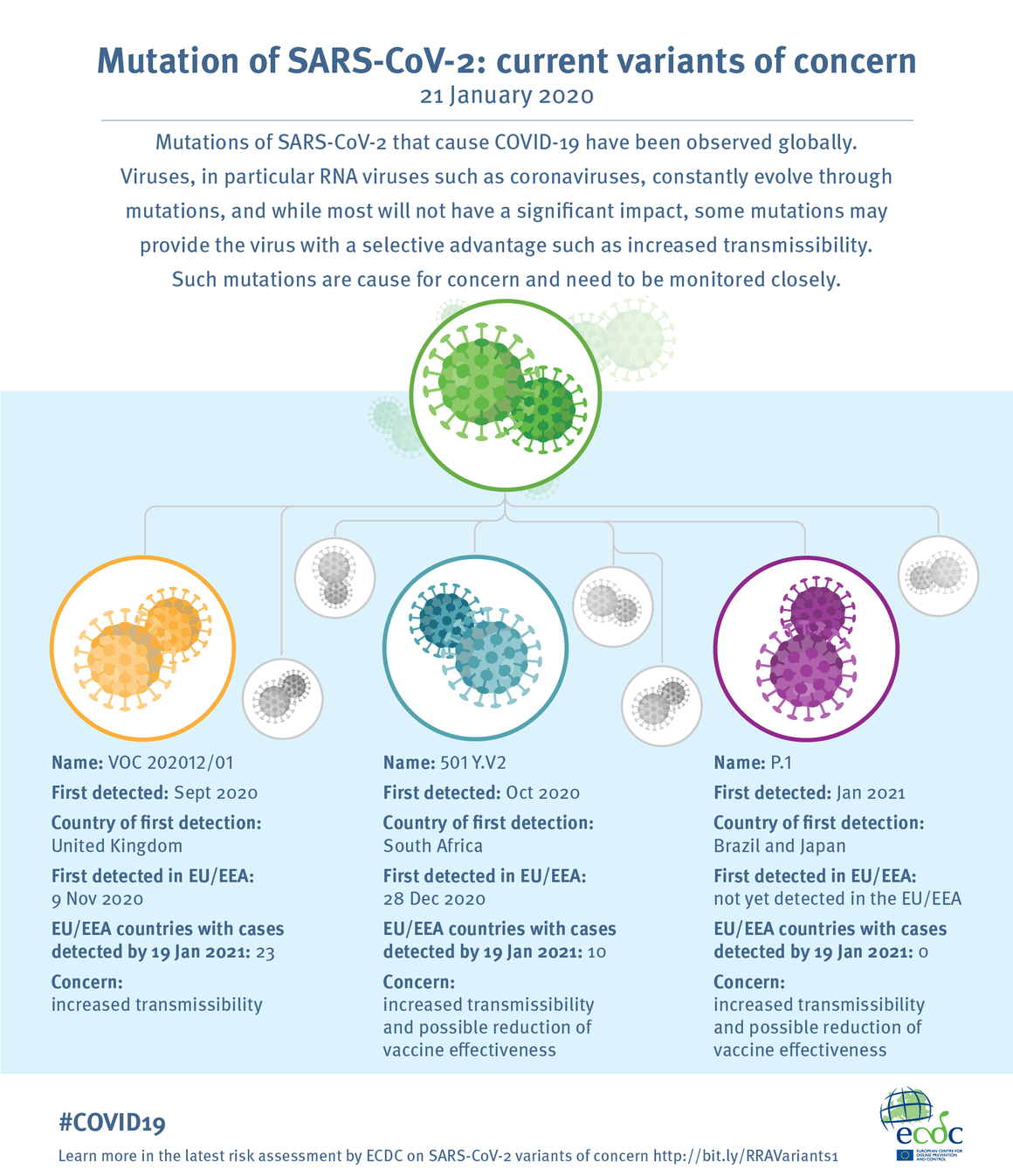
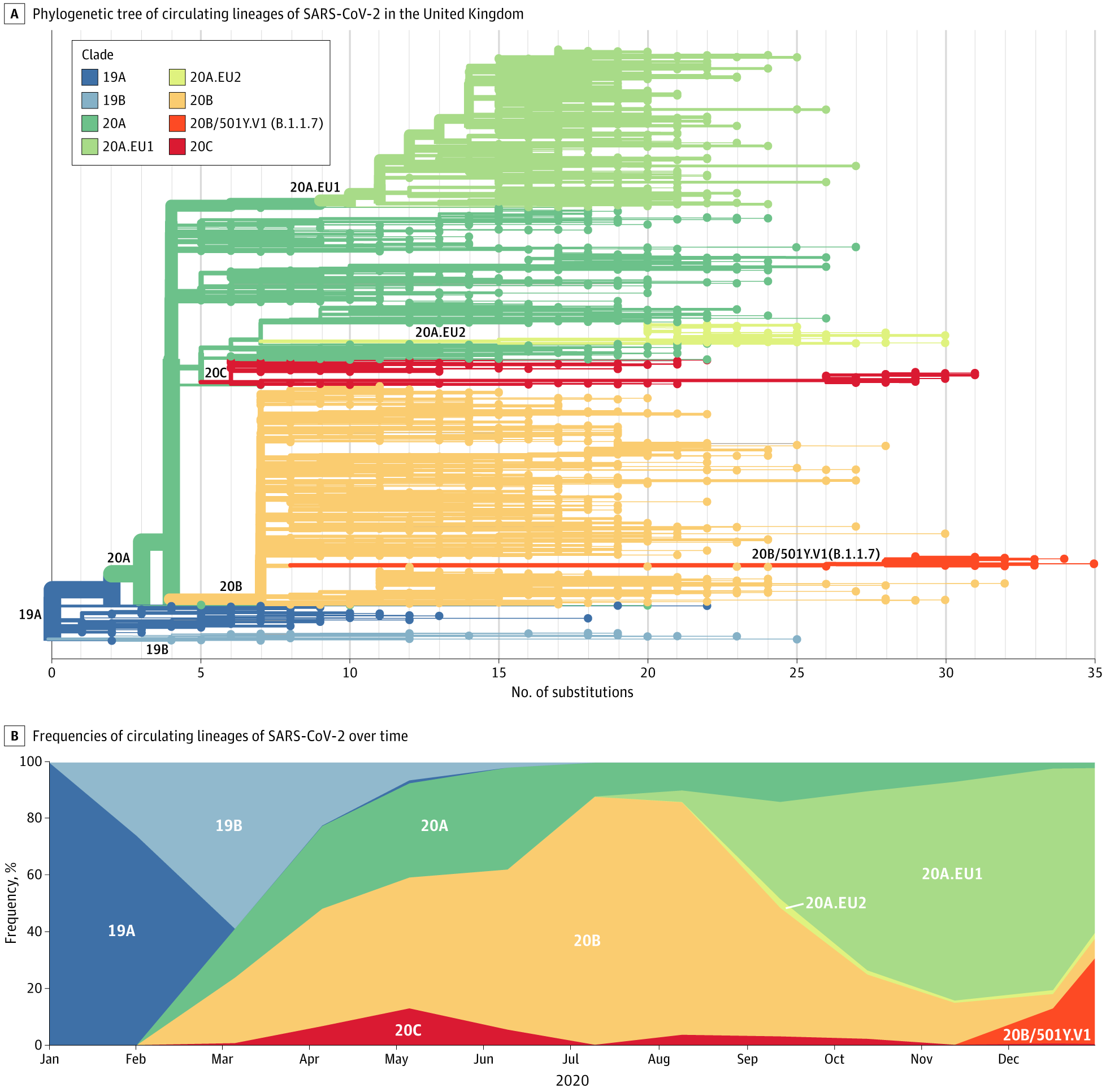
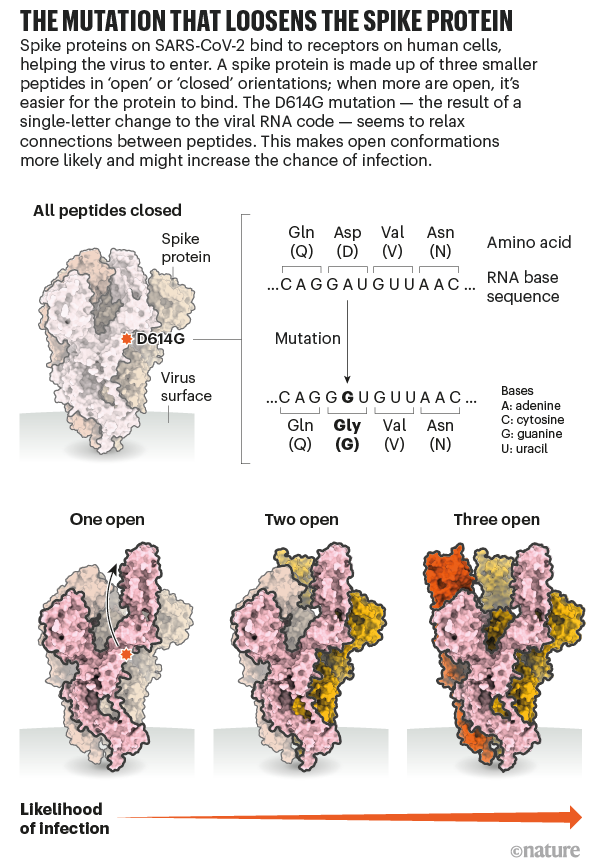
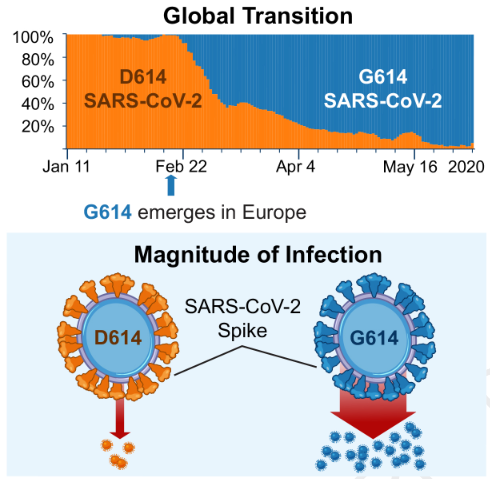
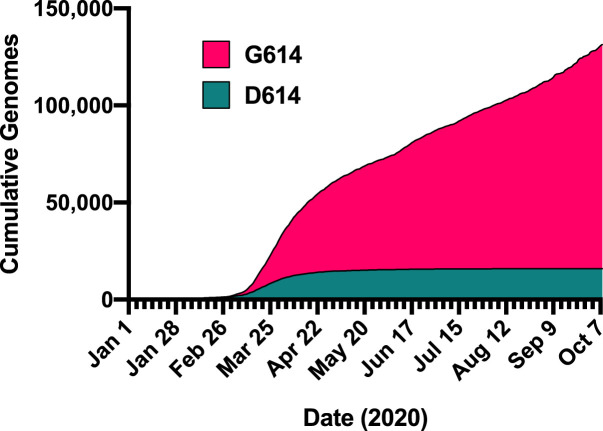
Desde el inicio de la pandemia Covid-19 hasta 19 abril de 2021, se han documentado más de 141 millones de casos y 3 millones de muertes en todo el mundo.
HECHOS
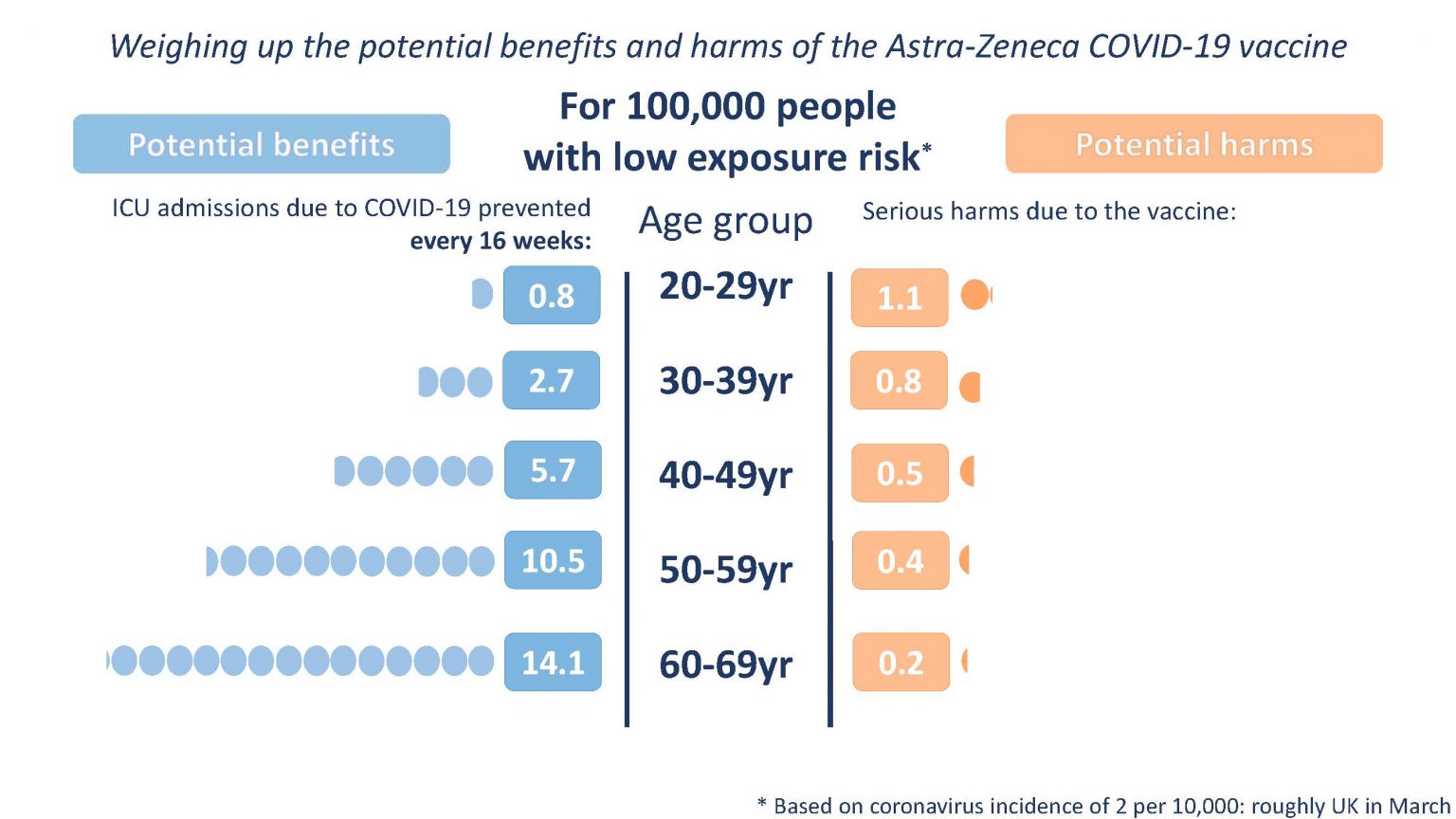
Agencia Europea de Medicamentos. A 4 de abril de 2021, se notificaron a EudraVigilance un total de 169 casos de trombosis del seno venoso cerebral y 53 casos de trombosis de la vena esplácnica, entre 34 millones de personas que habían sido vacunadas con ASTRAZENECA en el Espacio Económico europeo (EEE) y el Reino Unido hasta esta fecha, con 18 muertes. Riesgo de trombosis 0.00017% ≈ 1 por 100.000 vacunados.
EMA and FDA Estados Unidos
- Comité de Evaluación de Riesgos de Farmacovigilancia de la Agencia Europea de Medicamentos estudió ocho informes de Estados Unidos sobre casos graves de coagulación de la sangre entre los más de 7 millones de personas vacunadas. La EMA ha revisado ocho casos de coágulos sanguíneos inusuales en los EE. UU., uno de los cuales fue fatal, que ocurrió dentro de las tres semanas posteriores a la recepción de la vacuna Johnson & Johnson de dosis única. La agencia determinó que se debe agregar una advertencia a la información del producto de la vacuna. Y los beneficios generales de la vacuna superan los riesgos de efectos secundarios.
- Los 6 casos reportados anteriormente, ocurrieron entre mujeres de entre 18 y 48 años, y los síntomas se presentaron de 6 a 13 días después de la vacunación con 1 muerte. Riesgo de trombosis 0.00009%. Un caso por millón de vacunas
¿Qué tienen en común y en que se diferencian estas DOS VACUNAS?
Lo que ambas vacunas tienen en común:
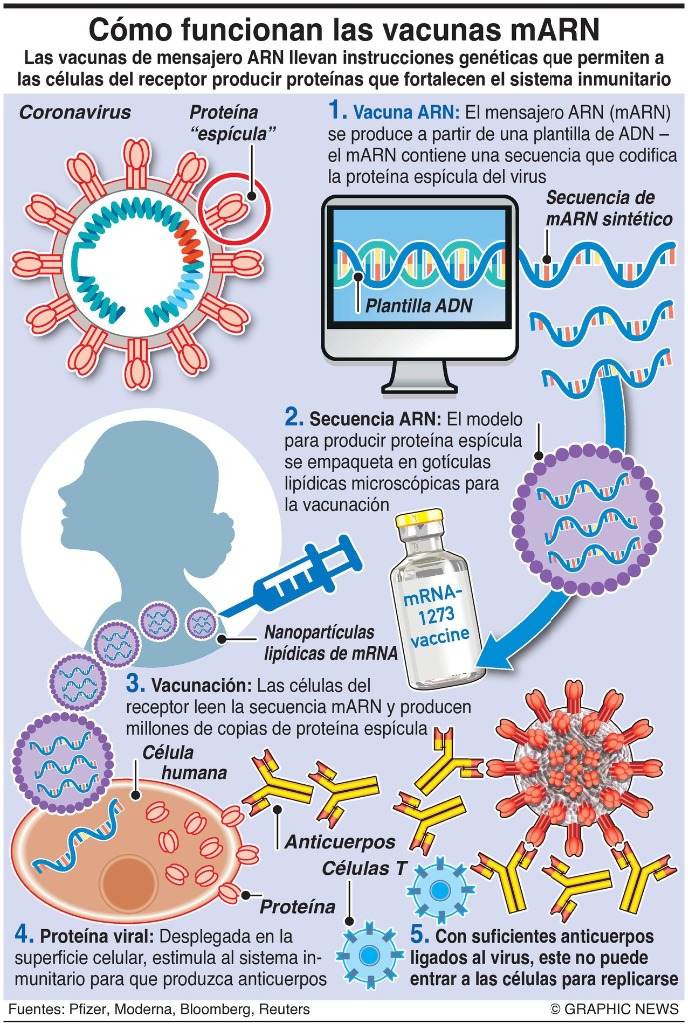
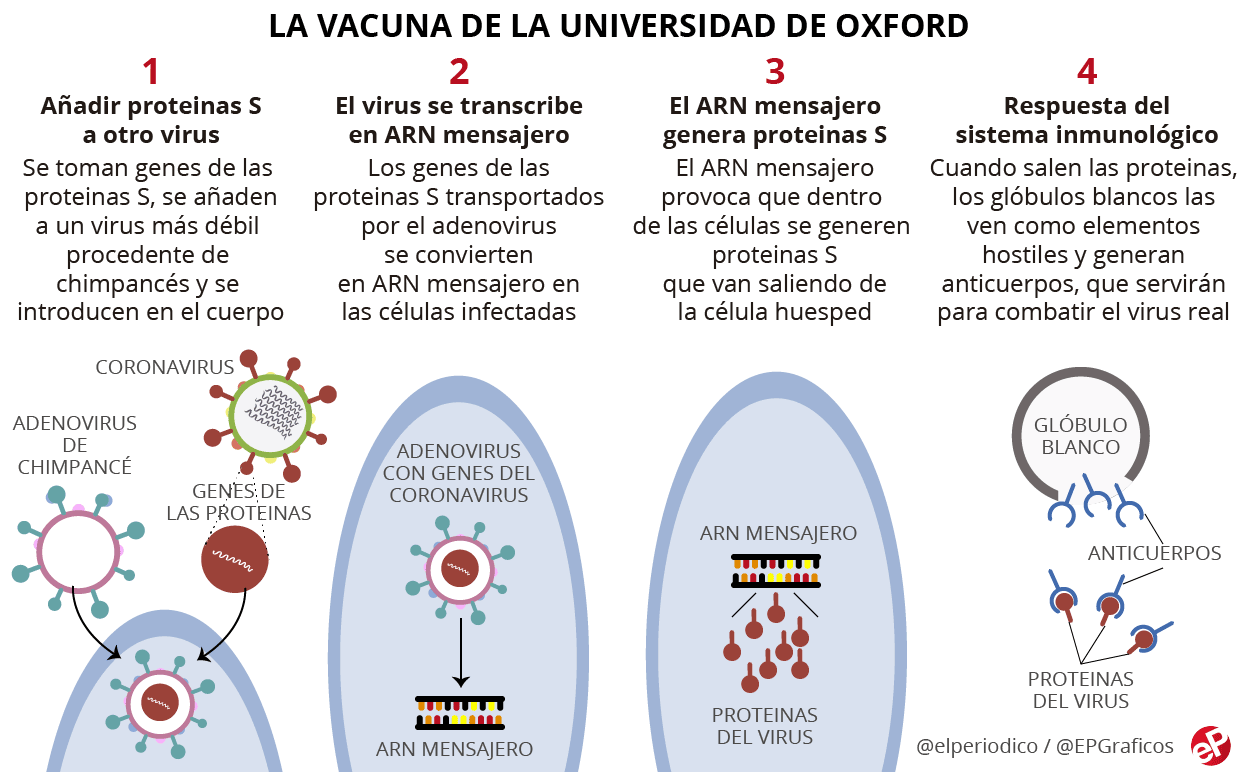
Son las llamadas vacunas vectoriales adenovirales, que utilizan virus de transporte que son inofensivos para los humanos para transportar el material genético de la proteína de pico del SARS-CoV-2 a las células, donde hace que las proteínas típicas se multipliquen y por lo tanto desencadena una respuesta inmune en el cuerpo.
Las dos vacunas de diferencian ligeramente
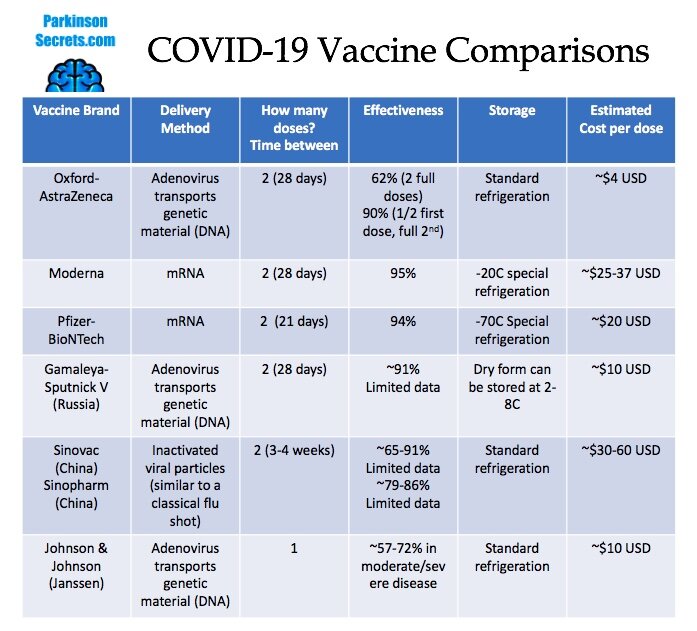
- La vacuna de Johnson & Johnson usa el vector "rAd26", porque la mayoría de la población carece de inmunidad preexistente contra él. Y tiene una eficacia ≈ 72%
- AstraZeneca usa un adenovirus que infecta a los chimpancés, llamado ChAdOx1 , con una eficacia ≈ 82,4%
AstraZeneca se ha utilizado ampliamente en Europa, pero aún no ha sido autorizado en los EE.
VACUNAS Y VECTORES PUEDEN EXPLICAR EL DISTINTO RIESGO DE TROMBOSIS
Hay seis vacunas de adenovirus-vector para COVID-19.
Además de AstraZeneca y Johnson & Johnson, está la vacuna Sputnik V desarrollada en Rusia, junto con CanSino de China y la vacuna Covishield en India.
Hasta el momento no se han notificado casos de trombocitopenia con la vacuna rusa Sputnik V o con la vacuna de vector chino CanSino.
Las diferentes vacunas también entregan conjuntos de instrucciones ligeramente diferentes para la proteína pico. Así los diferentes adenovirus usan diferentes puntos de acceso, conocidos como receptores, para ingresar a nuestras células. Esto puede resultar en un tamaño y tipo de respuesta inmune muy diferente.
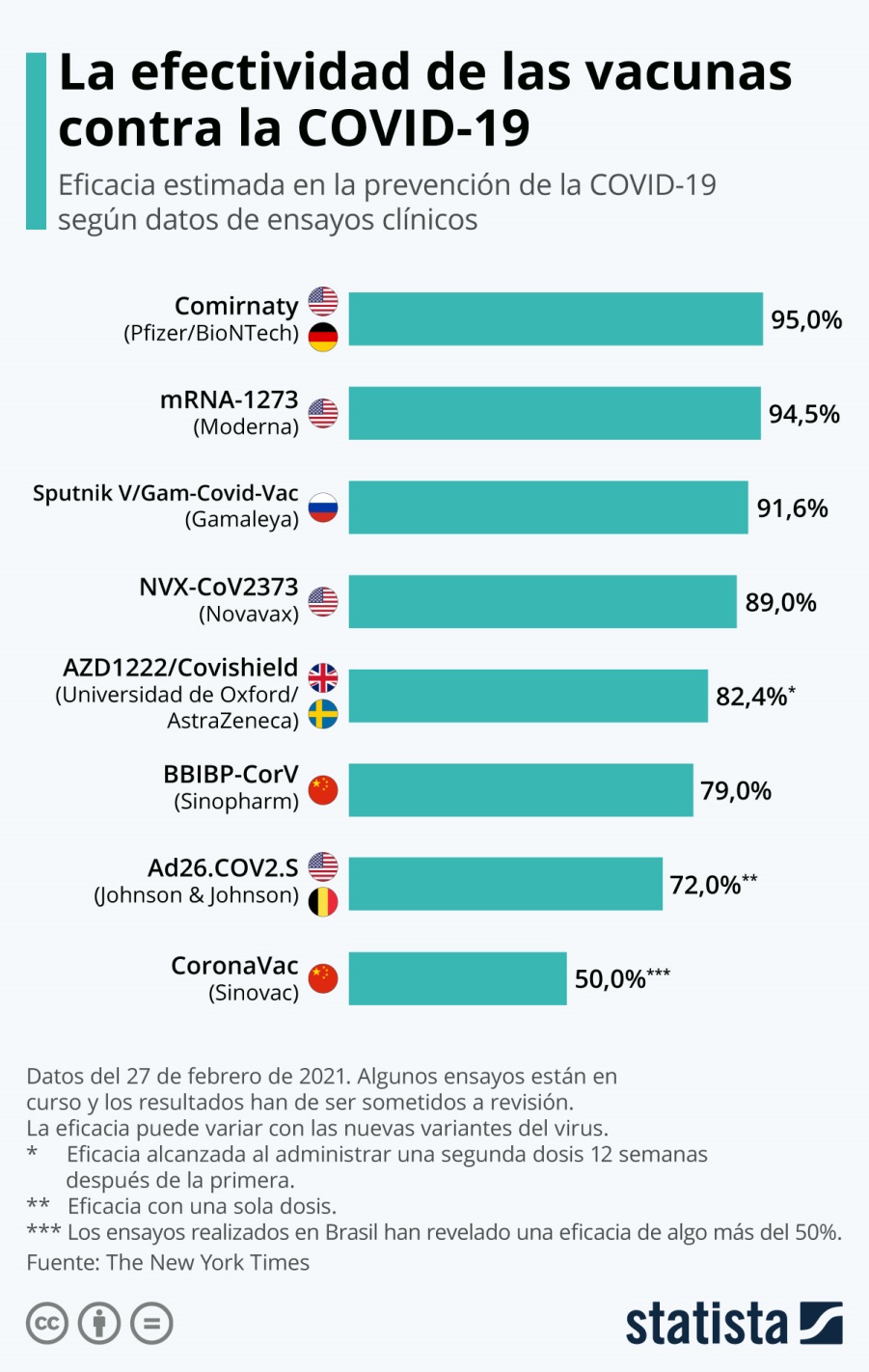
La estrategia de vacunación de Sputnik V es administrar dos vacunas, cada una con un tipo de adenovirus diferente (Ad26 recombinante [rAd26] seguido Ad5 recombinante [rAd5]). Esto es para evitar que se formen anticuerpos contra los vectores después de la primera vacunación y luego debiliten el efecto de la segunda vacunación, de ahí su eficacia del 91,6%.
La vacuna CanSino, utiliza el adenovirus 5 (Ad5-nCoV) que no es muy bueno para activar nuestro sistema inmunológico. Es decir es menos eficaz.
Mientras que otros vectores adenovirales son mejores como los de AstraZeneca y Johnson & Johnson
¿Qué tan comunes son las trombosis de las venas sinusales después de las vacunas?
Los casos son muy raros.
- A fecha 21 de marzo de 2021, en España se habían notificado 5 casos de trombosis de senos venosos, dos de ellos con trombocitopenia asociada, habiéndose administrado 985.528 dosis de la vacuna Vaxzevria (COVID-19 AstraZeneca). Uno de los casos tuvo desenlace mortal. (Además de la profesora fallecida en Málaga ha notificado otra persona con una trombosis abdominal y el primer paciente del fin de semana que sufrió una embolia cerebral. Se investigan también en Valencia trombos detectados en dos policías nacionales y un guardia civil). Desconozco cuantas eran mujeres y cuantos eran hombres)
- En el Reino Unido, donde se habían administrado alrededor de 18 millones de dosis de la vacuna AstraZeneca hasta el 24 de marzo, para entonces había habido 30 casos, siete de los cuales fueron fatales.
- En Alemania, con 2,7 millones de dosis de la vacuna administradas, hasta el 29 de marzo se habían registrado 31 casos, con nueve
- Para la vacuna de Johnson & Johnson, se informaron seis casos en los EE. UU. Hasta el 13 de abril, aunque no hubo muertes. Allí ya se habían administrado 6,8 millones de dosis.
Estas vacunas también pueden desencadenar otras trombosis atípicas, como trombosis de las venas abdominales y trombosis arteriales.
¿Más mujeres que hombres?
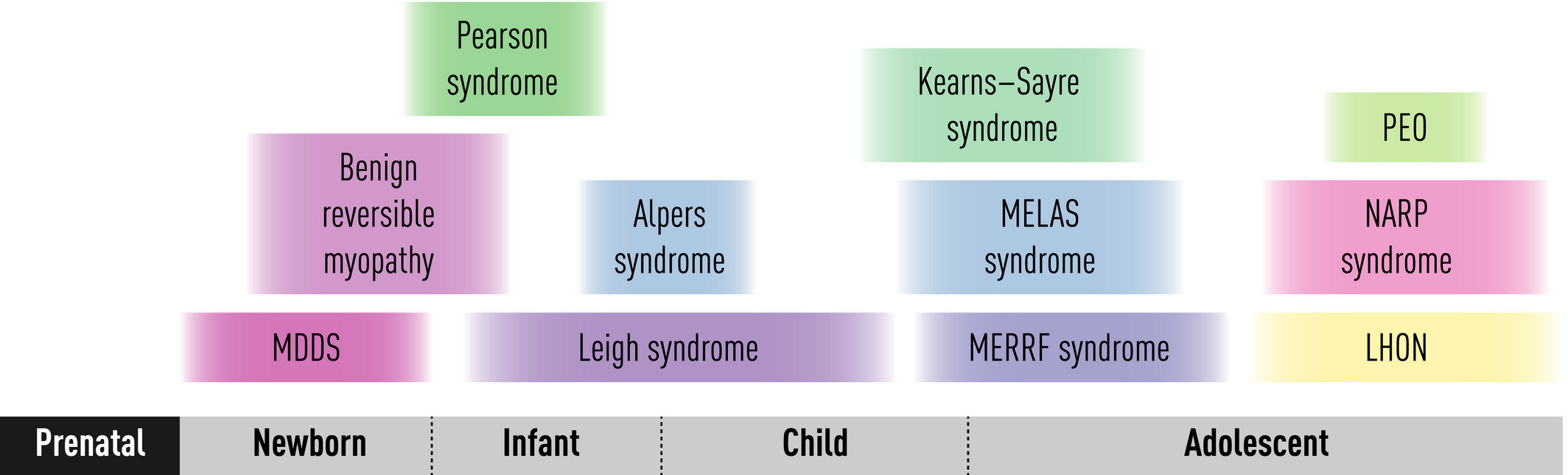
Más en mujeres que en hombres, y más en jóvenes que en personas mayores
- Los 8 casos notificados en los EE. UU. Después de una vacunación de Johnson & Johnson involucraron a mujeres de entre 18 y 48 años de edad, comenzando de 6 a 13 días después de la vacunación
- Después de vacunación con AstraZneca, 82% mujeres entre 22 a 49 años de edad, comenzando de 5 a 16 días después de la vacunación
¿Qué se sabe sobre sobre el mecanismo biológico?
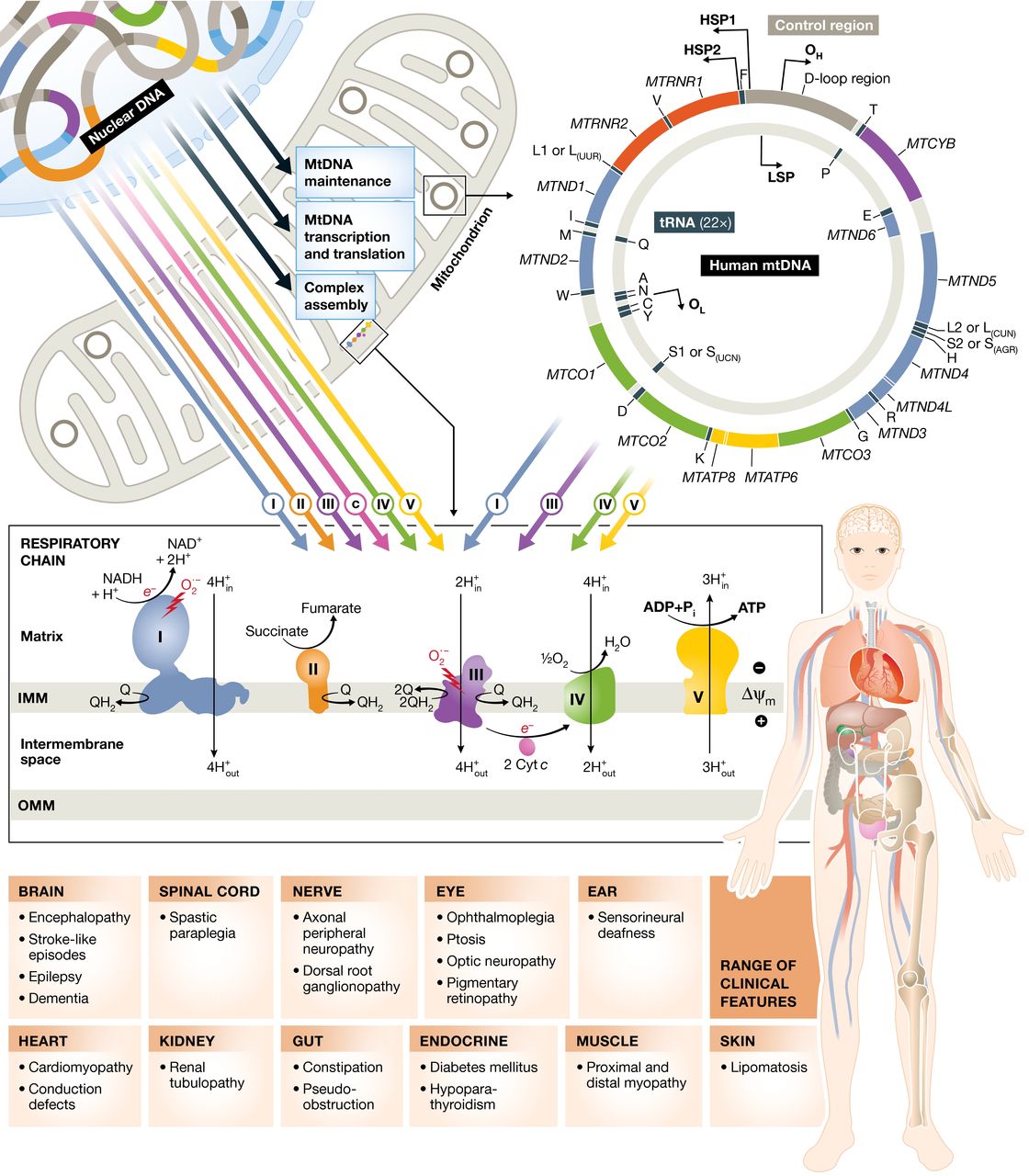
Los inmunólogos dirigidos por Andreas Greinacher en la Universidad de Greifswald pudieron descifrar los mecanismos sospechosos a fines de marzo. Aparentemente, se trata de una reacción autoinmune al llamado factor plaquetario 4, que es una proteína de superficie que participa en la respuesta inmune reuniendo células inmunes con ciertos receptores a su alrededor y así amplifica una respuesta inmune local.
Esta constelación de trombosis y trombocitopenia llevó a considerar la trombocitopenia inducida por heparina como diagnóstico. Sin embargo, ninguno de los pacientes había conocido una exposición a la heparina antes del inicio de la enfermedad. Aunque la patogenia de este síndrome de trombocitopenia trombótica inmunitaria inducida por vacunas (VITT) aún no está clara, ciertos hallazgos fueron consistentes en los tres estudios.
- En casi todos los pacientes, se identificaron altos niveles de anticuerpos contra el factor plaquetario 4 (PF4)-complejos polianión por ensayo de inmunoabsorción ligado a enzimas (ELISA), así como por ensayos basados en la activación plaquetaria, que, cuando se probó, se mejoró mediante la adición de PF4.
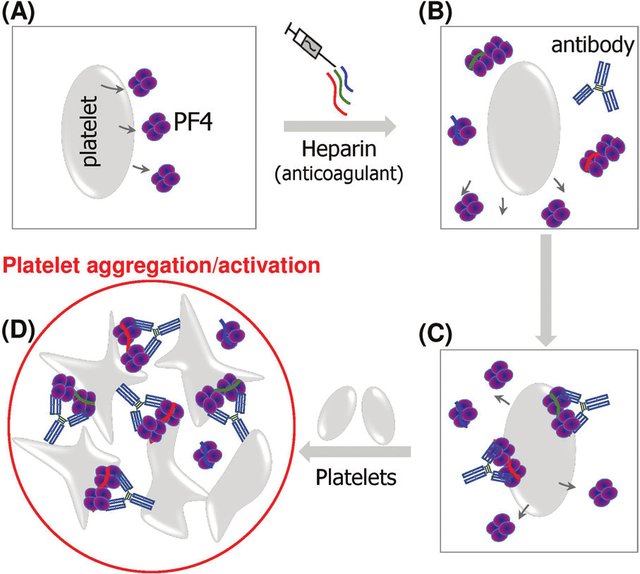
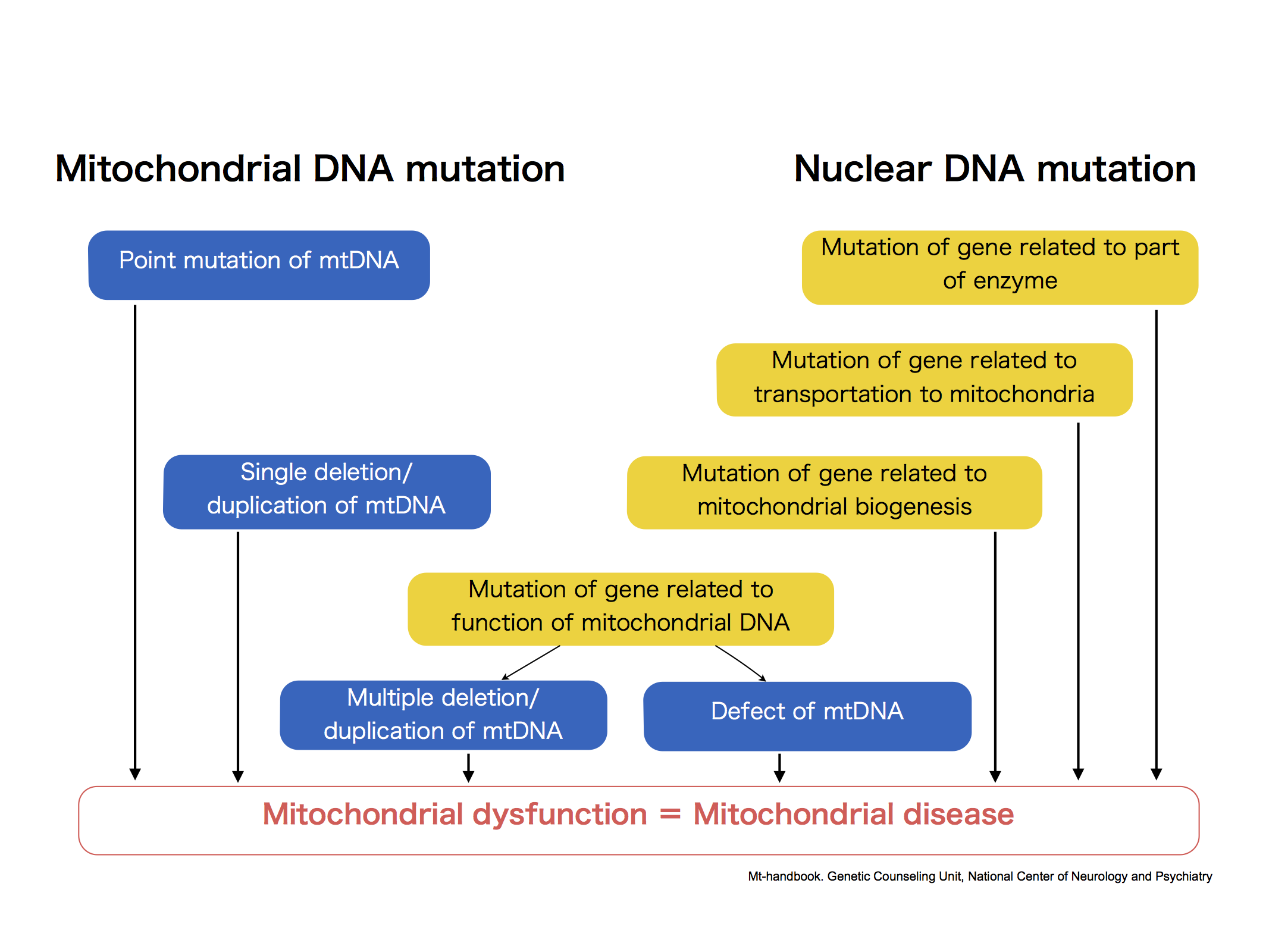
Trombocitopenia inducida por heparina (HIT). (A) Las plaquetas no activadas secretan varios PF4. (B) con la exposición a la heparina, los PF4 forman complejos ultra grandes con heparinas largas que inducen cambios conformacionales en los PF4. Algunos pacientes desarrollan Abs aPF4 / H contra neoepítopos de PF4. (C) Los complejos de PF4 / H unidos a aPF4 / H Abs derivados de seres humanos pueden adherirse a la membrana plaquetaria. (D) Las partes Fc de los anticuerpos se unen a los receptores fcγRIIa en las membranas plaquetarias, lo que conduce a la agregación / activación plaquetaria.
¿Qué es la trombocitopenia trombótica inmunitaria inducida por vacunas (VITT)?
Un síndrome caracterizado por:
- trombosis, particularmente en sitios inusuales que incluyen trombosis venosa del seno cerebral (CSVT) / trombosis esplácnica;
- trombocitopenia leve a grave;
- recientemente se describieron ensayos positivos de ELISA con heparina-PF4 y de activación plaquetaria en pacientes vacunados entre cinco y 16 días antes con la vacuna ChAdOx1 nCov-19 AZ, utilizada ampliamente en el Reino Unido, Europa y Canadá, pero aún no disponible en el Estados Unidos.
¿Cómo se sospechan clínicamente las trombosis?
Aunque los efectos secundarios graves son muy raros, si experimenta alguno de los siguientes síntomas entre cuatro días y cuatro semanas después de la vacunación, debe buscar atención médica urgentemente.
- un nuevo dolor de cabeza intenso que no mejora con los analgésicos habituales o que empeora
- un dolor de cabeza que parece peor al acostarse o inclinarse
- un dolor de cabeza inusual que puede ir acompañado de:
- visión borrosa, náuseas y vómitos
- dificultad con su habla
- debilidad, somnolencia o convulsiones
- Petequias o moretones con facilidad
- dificultad para respirar, dolor de pecho
- hinchazón de la pierna
- dolor abdominal persistente
¿Cómo se puede identificar correctamente la trombosis?
Si los médicos sospechan un caso de trombosis, pueden diagnosticar la afección muy rápidamente mediante niveles de fibrinógeno bajos o normales y niveles elevados de dímero D en el momento de la presentación, y una simple prueba de anticuerpos contra el factor plaquetario 4 (PF4). Así cómo con pruebas de imágenes para trombosis basadas en síntomas, enfocadas en la detección de trombosis venosa del seno cerebral (CSVT) con CT o MRI venograma, trombosis esplácnica y / o embolia pulmonar
¿Cómo se tratan las trombosis?
- Inmunoglobulina G Intravenosa (IgIV ) 1 gramo / kg al día X 2 días
- Anticoagulación sin heparina, elegida en función del estado clínico y la función orgánica del paciente:
- Inhibidores de trombina parenterales directos (argatroban o bivalrudina siempre que el aPTT basal sea normal),
- Anticoagulantes orales directos sin fase inicial de heparina
- Fondaparinux, o
- Danaparoid
Recomendaciones
Muchos países de Europa han reaccionado imponiendo restricciones de edad a la vacuna AstraZeneca, que varían según el país.
- España ha limitado la vacuna astrazeneca a la población entre 60 y 69 años
- Alemania y los Países Bajos han limitado la vacuna a personas mayores de 60 años; Francia estableció la edad de 55 años como umbral.
- El Comité Conjunto de Vacunación e Inmunización de Gran Bretaña ha recomendado que a las personas menores de 30 años sin condiciones médicas subyacentes se les debe ofrecer una vacuna diferente.
- Noruega ha detenido las vacunas por completo, al menos por ahora.
- En otras partes del mundo, Canadá, Australia y Filipinas también han impuesto restricciones de edad.
En la actualidad, existe suficiente evidencia para sugerir que la vacuna Oxford / AstraZeneca y es posiblemente la causa de coágulos sanguíneos raros y hemorragias entre un número muy pequeño de personas que han recibido la vacuna.
La Agencia Europea de Medicamentos (EMA) encuentra un posible vínculo con casos muy raros de coágulos sanguíneos inusuales con plaquetas bajas en sangre en vacunados Janssen / Johnson & Johnson. Pero los beneficios generales de la vacuna superan los riesgos de efectos secundarios
CONCLUSIONES
- Riesgo de trombosis: Vacuna AstraZeneca 1 por 100.000 vacunados; Vacuna Janssen/Johnson & Johnson 1 por millón de vacunados.
- Muertes por trombosis: AstraZeneca 18; Janssen/Johnson & Johnson 1
- Edad, sexo y tiempo de aparición: AstraZeneca 22 a 49 años, 80% mujeres, 5 a 16 días; Janssen/Johnson & Johnson 18 a 48 años, 100% mujeres, 6 a 13 días
- Eficacia de las vacunas: AstraZeneca 1ª dosis (76%), 2ª dosis – sí intervalo < 6 semanas (55%); sí intervalo ≥ 12 semanas (81%) y total (67%). Janssen/Johnson & Johnson una sola dosis 72%.
- España ha limitado la vacuna AstraZeneca a la población entre 60 y 69 años y la vacuna Janssen/Johnson & Johnson entre 70 y 79 años de edad.
- Tratamiento de las trombosis: Inmunoglobulina G Intravenosa (IgIV ) 1 gramo / kg al día X 2 días y Anticoagulación sin heparina.
REFERENCIAS
- Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med. 2021 Apr 9. doi: 10.1056/NEJMoa2104840. Epub ahead of print. PMID: 33835769.
- Schultz NH, Sørvoll IH, Michelsen AE, Munthe LA, Lund-Johansen F, Ahlen MT, Wiedmann M, Aamodt AH, Skattør TH, Tjønnfjord GE, Holme PA. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. N Engl J Med. 2021 Apr 9. doi: 10.1056/NEJMoa2104882. Epub ahead of print. PMID: 33835768.
- Cines DB, Bussel JB. SARS-CoV-2 Vaccine-Induced Immune Thrombotic Thrombocytopenia. N Engl J Med. 2021 Apr 16. doi: 10.1056/NEJMe2106315. Epub ahead of print. PMID: 33861524.
PROF DR. FERNANDO GALAN