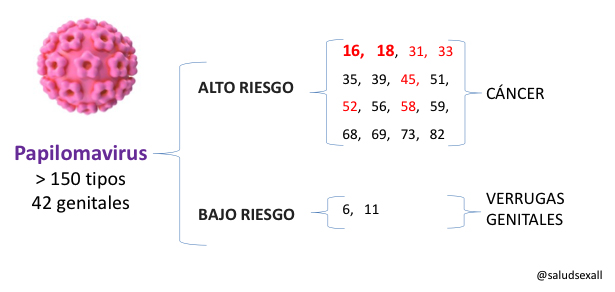
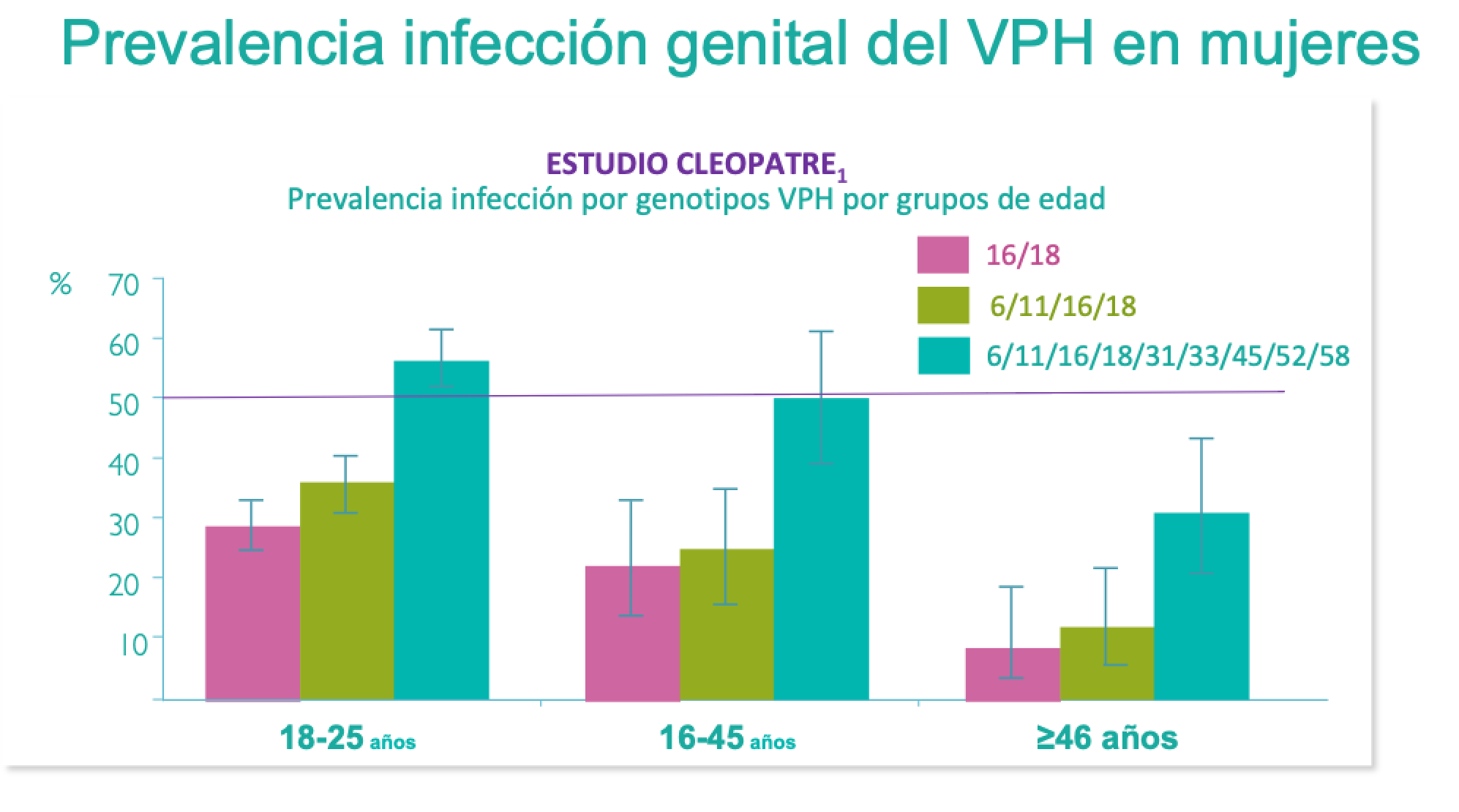
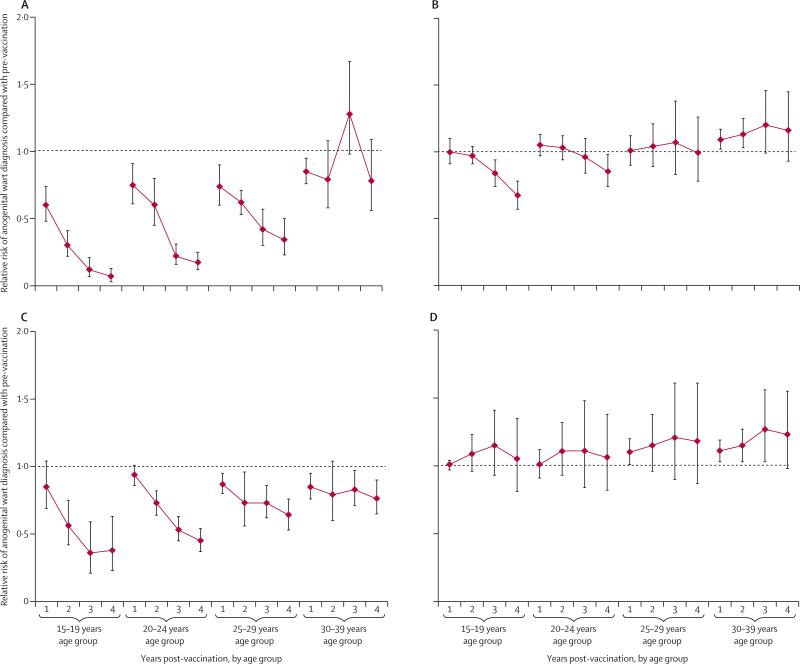
Varias compañías están trabajando ahora con clínicas de fecundación in vitro (FIV) para ofrecer "selección de embriones basada en puntuaciones poligénicas" (ESPS) a pacientes que desean seleccionar un embrión con una probabilidad menor que otros embriones de desarrollar, en la edad adulta, diabetes, cáncer, enfermedad cardíaca, enfermedad inflamatoria intestinal, enfermedad de Alzheimer y esquizofrenia.
- Otra empresa también ofrece ESPS para seleccionar embriones de acuerdo con su nivel educativo previsto, los ingresos familiares y la capacidad cognitiva.
- El fundador de otra empresa no ha descartado algún día ofrecer ESPS en algunos países para el color de la piel o la capacidad cognitiva por encima de la media.
Un equipo multinacional de investigadores describe las limitaciones y riesgos del nuevo servicio, en un INFORME ESPECIAL publicado el 1 de julio de 2021 en el New England Journal of Medicine, planteando serias dudas sobre los beneficios, los riesgos y la ética de un nuevo servicio, que los autores denominan "selección de embriones basada en puntuaciones poligénicas" o ESPS, que permite a los pacientes de fertilización in vitro seleccionar embriones con el objetivo de elegir niños más sanos e incluso más inteligentes.
El equipo multinacional de investigadores describe las limitaciones de la ESPS y advierte del riesgo de que los pacientes e incluso los médicos de fertilización in vitro (FIV) puedan tener la impresión de que la ESPS es más eficaz y con menos riesgos de lo que es.
- Los autores destacan que, dado que el mismo gen a menudo influye en muchos rasgos diferentes, las ESPS diseñadas para seleccionar un rasgo pueden llevar a la selección involuntaria de rasgos adversos.
- También advierten sobre el potencial de las ESPS para alterar la demografía de la población, exacerbar las desigualdades socioeconómicas y devaluar ciertos rasgos.
Si ESPS sigue estando disponible para los pacientes de FIV, los investigadores piden a la Comisión Federal de Comercio que desarrolle y haga cumplir los estándares para la comunicación responsable sobre el servicio. Los autores también piden una conversación en toda la sociedad sobre el uso ético de la tecnología y si debe regularse.
Las puntuaciones poligénicas son predicciones de la salud individual y otros resultados derivados de estudios de asociación de todo el genoma. Se ha demostrado que las puntuaciones poligénicas, en adultos, predicen parcialmente esos resultados. Sin embargo, como explican los autores, su poder predictivo se reduce significativamente cuando se comparan embriones entre sí.
"Los puntajes poligénicos ya son solo predictores débiles para la mayoría de los resultados individuales de los adultos, especialmente para los rasgos sociales y de comportamiento, y hay varios factores que reducen su poder predictivo aún más en el contexto de la selección de embriones", dijo Patrick Turley, profesor asistente de investigación de economía en la Facultad de Letras, Artes y Ciencias de USC Dornsife y co-primer autor del artículo. "Los puntajes poligénicos están diseñados para funcionar en un entorno diferente al de una clínica de FIV. Estos predictores débiles funcionarán aún peor cuando se utilicen para seleccionar embriones".
Turley y sus colegas modelaron, para varias enfermedades, la diferencia esperada en el riesgo de la enfermedad del futuro individuo entre usar ESPS para seleccionar un embrión versus elegir un embrión al azar entre 10 embriones viables. En la mayoría de los casos, la reducción del riesgo absoluto de la ESPS es muy pequeña. Además, estas estimaciones son extremadamente inciertas, tanto que el efecto de la ESPS se ve inundado por la variación de fondo.
Inconvenientes de ESPS
Para que la ESPS funcione, las puntuaciones poligénicas deben proporcionar predicciones al menos moderadamente precisas de si los individuos resultantes tendrán un determinado rasgo o no. Los estudios de asociación de todo el genoma que generan las puntuaciones poligénicas a veces sugieren diferencias moderadas o incluso grandes en los resultados reales entre personas con puntuaciones poligénicas altas o bajas, pero esas diferencias se basan en una muestra de personas de diferentes familias. Sin embargo, como señalan Turley y sus colegas, la ESPS generalmente implica comparar miembros de la misma familia, lo que reduce significativamente el poder predictivo de las puntuaciones poligénicas.
Además, por razones estadísticas, los estudios de asociación de todo el genoma se llevan a cabo con personas con ascendencia similar. Desafortunadamente, por una variedad de razones, los estudios existentes han incluido de manera desproporcionada a personas con ascendencia europea. Como resultado, la mayoría de las puntuaciones poligénicas construidas hoy serán menos predictivas para personas de otras ascendencias.
Por último, las evaluaciones del poder predictivo de las puntuaciones poligénicas suelen asumir entornos muy similares para la generación que se inscribió en el estudio original de asociación de todo el genoma y la generación que nacerá como resultado de la ESPS. Pero para cuando un embrión seleccionado por ESPS sea adulto, es posible que se enfrente a un entorno muy diferente, lo que reducirá el poder de predicción.
Incluso si la eficacia limitada de ESPS se comunica con precisión a los pacientes, el uso generalizado de ESPS plantea otros riesgos.
- Por ejemplo, los investigadores advierten que el uso de ESPS podría exacerbar la salud existente y otras disparidades, ya que ESPS solo es accesible en gran medida para los relativamente ricos y actualmente predice mejor los resultados entre aquellos con ascendencia europea.
- ESPS también podría amplificar los prejuicios y la discriminación al señalar que las personas existentes con rasgos que los padres seleccionan son menos valiosas.
"Algunos países tienen autoridades que deciden qué rasgos se pueden analizar en los embriones", dijo Michelle N. Meyer, profesora asistente de bioética y académica jurídica en Geisinger Health System y coautora primera del informe especial. "Pero en los EE. UU., Existe una fuerte tradición legal y ética de ver las decisiones reproductivas como asuntos de elección individual privada. A corto plazo, la Comisión Federal de Comercio (FTC) debería ayudar a establecer lo que cuenta como evidencia adecuada para respaldar las afirmaciones sobre los beneficios esperados de la ESPS y lo que cuenta como divulgación de información adecuada en este contexto ".
Los investigadores también piden que las sociedades médicas profesionales desarrollen políticas y orientación en este espacio y que las propias empresas demuestren que la información que brindan a los diversos clientes es completa, precisa y bien entendida.
También dicen que es necesario que haya una conversación en toda la sociedad sobre si el uso de los marcos legales existentes para garantizar información precisa sobre las ESPS es suficiente, junto con si se deben adoptar límites al uso de las ESPS.
"Muchas decisiones reproductivas individuales, agregadas a lo largo de generaciones, pueden tener profundas consecuencias sociales", dijo Daniel J. Benjamin, autor correspondiente y profesor de la Facultad de Administración Anderson de UCLA y la Facultad de Medicina David Geffen. "En conjunto, estas decisiones podrían alterar la demografía de la población, exacerbar las desigualdades y devaluar los rasgos que se oponen a la selección".
El Colegio Americano de Genética Médica y Genómica se ha posicionado también respecto a los valores poligénicos en pruebas prenatales, especialmente en lo que respecta a las pruebas directas al consumidor que los utilizan.
A través de un artículo publicado en Genetics in Medicine los directores del ACMG indican que, pese a los últimos avances, incluso con las tecnologías más sofisticadas, los estudios genéticos sobre enfermedades o características complejas representan una ciencia inexacta y no pueden identificar a individuos afectados como lo hacen las pruebas dirigidas a trastornos monogénicos.
CONCLUSIONES
- Los puntajes poligénicos están diseñados para funcionar en un entorno diferente al de una clínica de FIV. Estos predictores débiles funcionarán aún peor cuando se utilicen para seleccionar embriones".
- Los autores destacan que, dado que el mismo gen a menudo influye en muchos rasgos diferentes, las ESPS diseñadas para seleccionar un rasgo pueden llevar a la selección involuntaria de rasgos adversos.
- El Colegio Americano de Genética Médica y Genómica indican que, pese a los últimos avances, incluso con las tecnologías más sofisticadas, los estudios genéticos sobre enfermedades o características complejas representan una ciencia inexacta y no pueden identificar a individuos afectados como lo hacen las pruebas dirigidas a trastornos monogénicos.
REFERENCIA
- Patrick Turley, Michelle N. Meyer, Nancy Wang, David Cesarini, Evelynn Hammonds, Alicia R. Martin, Benjamin M. Neale, Heidi L. Rehm, Louise Wilkins-Haug, Daniel J. Benjamin, Steven Hyman, David Laibson, Peter M. Visscher. Problems with Using Polygenic Scores to Select Embryos. New England Journal of Medicine, 2021; 385 (1): 78 DOI: 10.1056/NEJMsr2105065
- ACMG Board of Directors. Direct-to-consumer prenatal testing for multigenic or polygenic disorders: a position statement of the American College of Medical Genetics and Genomics (ACMG). Genet Med (2021). https://doi.org/10.1038/s41436-021-01247-1
PROF. DR. FERNANDO GALAN