Fernando Galán Galán
Profesor Titular de Medicina
Especialista en Medicina Interna
Experto en Miopatía Mitocondrial del Adulto
Fibromialgía y Síndrome de Fatiga crónica
BLOG
LA FDA ESTABLECE NUEVAS RESTRICCIONES PARA EL IMPLANTE PERMANENTE DEL ANTICONCEPTIVO “ESSURE” DE BAYER.
La Administración de Alimentos y Medicamentos (FDA) emitió una orden para restringir la venta y distribución de Essure de Bayer, un dispositivo de anticoncepción permanente, para garantizar que todas las mujeres que consideren su uso estén adecuadamente informadas sobre los riesgos asociados con el dispositivo antes de tomar una decisión.
Essure, aprobado por la FDA en 2002, es un dispositivo anticonceptivo implantado permanentemente para mujeres que no requiere una incisión quirúrgica. La espiral de alambre flexible se inserta a través de la vagina y el cuello uterino, en ambas trompas de Falopio. Alrededor de ~ 3 meses, se forma tejido alrededor del dispositivo, y constituye una barrera que evita que los espermatozoides lleguen al óvulo.
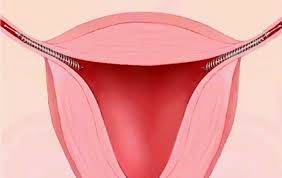
La FDA anunció su decisión después de enterarse de que algunas mujeres aún no estaban siendo informadas adecuadamente de los riesgos asociados con Essure, antes de la implantación, a pesar de los esfuerzos para educar a los médicos y pacientes sobre estos riesgos.
Se han notificado en algunas mujeres después del implante Essure, eventos adversos como:
- perforación del útero y / o trompas de Falopio,
- migración del dispositivo a la cavidad abdominal o pélvica,
- dolor persistente
- y sospecha de reacciones alérgicas o de hipersensibilidad
En febrero de 2016, la FDA requirió a Bayer llevar a cabo un estudio post-comercialización que dio lugar a la adición de un recuadro de advertencia y lista de verificación de decisión del paciente al etiquetado 7 meses más tarde.
Aunque las ventas de Essure han disminuido en ~ 70%, la FDA cree que algunas mujeres todavía no están siendo informadas sobre los riesgos establecidos de Essure antes de la implantación.
El comisionado de la FDA, Scott Gottlieb, dijo: "A pesar de los esfuerzos anteriores para alertar a las mujeres sobre las posibles complicaciones de Essure, sabemos que algunos pacientes aún no reciben esta información importante. Eso es simplemente inaceptable. "Todas las mujeres que reciben este dispositivo deben entender los riesgos asociados ".
9 de abril de 2018
TRADUCIDO COMENTADO POR: PROF. DR. FERNANDO GALAN




