¿Por qué al buscar en Internet SÍNDROMES DE LA SENSIBILIDAD CENTRAL- en plural- aparece SÍNDROME DE SENSIBILIDAD CENTRAL- en singular-?
“En una carta del Presidente de la Sociedad Española de Síndrome de Sensibilidad Central (SESSEC). Refiere que esta sociedad se ocupa del estudio, diagnóstico y tratamiento de las enfermedades que componen el Síndrome de sensibilidad central (SSC), (observen que escribe Síndrome en singular). Fibromialgia, Fatiga crónica, Cefalea y Migraña, Síndrome de intestino irritable, Síndrome químico múltiple, así como de otras patologías que suponemos englobadas en el Síndrome de sensibilidad central (SSC).”
Aquí se refiere al Síndrome de sensibilidad central (SSC) en singular, sugiriendo un nuevo síndrome que sustituye a todos los síndromes crónicos comunes existentes como: la fibromialgia (FM), el síndrome de fatiga crónica/encefalomielitis miálgica (SFC/EM), el síndrome del colon/intestino irritable, la cistitis intersticial, algunos dolores de cabeza temporales y migrañas.
La gran confusión se origina al fusionar síndromes clínicos distintos – referidos anteriormente – bajo el nuevo término de SÍNDROME DE SENSIBILIDAD CENTRAL, que NO existe.
Podría dar la impresión, que el título usado es una afirmación muy tajante. Pero en este artículo pretendo clarificar, basado en los datos actuales, la CONFUSIÓN terminológica existente hoy en día, entre - SENSIBILIDAD CENTRAL; SÍNDROME DE SENSIBILIDAD CENTRAL y SÍNDROMES DE SENSIBILIDAD CENTRAL - al pretender encontrar un mecanismo explicativo de los síndromes crónico comunes como: la fibromialgia (FM), el síndrome de fatiga crónica/encefalomielitis miálgica (SFC/EM), el síndrome del colon/intestino irritable, la cistitis intersticial, algunos dolores de cabeza temporales y migrañas, entre otros. Y más recientemente, también se han añadido la sensibilidad química múltiple (SQM) y la electrohipersensibilidad (EHS).
En la última década, una serie de afecciones de dolor crónico comunes, históricamente consideradas síndromes independientes, se han sugerido incluirlas bajo la nomenclatura de SÍNDROMES DE LA SENSIBILIDAD CENTRAL (CSSs) debido a algunos síntomas superpuestos.
No existe una explicación generalmente aceptada sobre cómo o por qué se desarrolla la supuesta sensibilización central en estos síndromes o Condiciones de dolor crónico superpuesto - Chronic Overlapping Pain Conditions (COPCs) reconocido por los Institutos Nacionales de Salud y el Congreso de los EE. UU.
- Fibromialgia
- Síndrome de fatiga crónica (enfermedad sistémica de intolerancia al esfuerzo [SEID])
- Síndrome del intestino irritable
- Síndrome de dolor pélvico crónico/dismenorrea primaria
- Dolor en la articulación temporomandibular
- Dolores de cabeza de tipo tensional/migraña
- Trastorno de estrés postraumático (TEPT)
- Sensibilidad química múltiple
- Trastorno del movimiento periódico de las extremidades/síndrome de piernas inquietas
- Cistitis intersticial
La etiología subyacente y la fisiopatología de los CSSs no se comprenden completamente en este momento; sin embargo, como sugiere el nombre, se considera que el CS ocurre principalmente en el sistema nervioso central.
CONFUSIÓN TERMINOLÓGICA
SENSIBILIDAD CENTRAL (SC) es una hipótesis.
El término sensibilización central (SC) del dolor, que fue una hipótesis acuñada por Woolf y King en 1989, después de que estudios en ratas mostraran, que las neuronas de la médula espinal se vuelven hiperexcitables con el tiempo después de una lesión.
- Hipótesis es una predicción o explicación provisional (mientras no sea contrastada). Cualquier hipótesis debe ser probada mediante hechos, pruebas directas y evidencias de datos,
Hasta la fecha, el término SC carece de una definición estructurada basada en el consenso de expertos. Aunque la existencia de SC está demostrada en estudios con animales, estas evaluaciones no pueden realizarse en humanos. La SC está estudiada en animales con registros electrofisiológicos directos de las neuronas centrales que NO es posible realizar en humanos . Los principios encontrados en estudios con animales se han aplicado a estudios centrados en humanos . Por lo tanto, la SC debe considerarse como una hipótesis utilizada para explicar las condiciones de dolor en humanos, adoptado de estudios con animales. Para abordar esto y esperar pruebas de SC en humanos, se ha introducido el término Sensibilización central asumida por humanos (HACS) para estudios en humanos.
Dado que los registros electrofisiológicos directos de las neuronas centrales NO son una opción en los seres humanos, el término "sensibilización central" debería utilizarse con cautela en los seres humanos.
Actualmente no se dispone de ningún método definitivo para diagnosticar el SC, ni criterios diagnósticos absolutos para identificar la presencia de sensibilización central en los pacientes
La sensibilización central es una hipótesis para explicar varios síndromes de dolor crónico diferentes, pero no es un diagnóstico médico formal en sí misma.
Actualmente, ninguna prueba puede determinar de manera concluyente que una persona tenga sensibilización central. En las últimas décadas muchos autores se han centrado en la sensibilización central como uno de los mecanismos subyacentes al dolor crónico y más recientemente también se ha postulado la SC como una posible explicación para el síndrome de fibromialgia (FMS) y las condiciones crónicas superpuestas, por ejemplo, síndrome del intestino irritable y síndrome de fatiga crónica.
La sensibilización central se ha descrito en la investigación básica y, por lo tanto, es polémica cuando se generaliza a contextos clínicos. Actualmente, no hay evidencia que demuestre una sensibilización central (como la descrita por Woolf en ratas), en sujetos humanos, y las herramientas de evaluación actuales para humanos, no son aptas para la medición directa de los fenómenos neurofisiológicos
Los pacientes tienen diversos síntomas y acuden a distintos médicos:
- al neurólogo por el dolor de cabeza,
- al digestivo por los síntomas digestivos y
- al internista o reumatólogo debido a los dolores musculares o el cansancio.
Cada médico se ocupa de su especialidad, sin interferir en otros síntomas, lo que dificulta el diagnóstico, ya que no ven el conjunto del cuadro que el paciente presenta. Al final, éste termina con tratamiento sintomático ineficaz.
Todavía hoy existe discusión sobre la definición de Sensibilidad Central (SC). Algunos autores, por ejemplo Hansson, han advertido sobre una definición demasiado amplia de SC, argumentando: “un cuerpo importante de literatura clínica y experimental en humanos interpreta una multitud de síntomas y signos como expresiones de SC, hasta un punto que NO está respaldado por la evidencia de las investigaciones actuales”.
La hipótesis de la sensibilización central, en resumen, es una supuesta explicación para una hipersensibilidad a estímulos que normalmente no son dolorosos.
La hipersensibilidad al dolor por sí sola no es suficiente para hacer un diagnóstico irrefutable de sensibilización central
La sensibilización central (CS), es tan solo una hipótesis en la medicina clínica. Con esta hipótesis se ha intentado ayudar a explicar aspectos de síndromes crónicos comunes, por ejemplo, el síndrome de fibromialgia (FMS), el síndrome del intestino irritable, la vulvodinia, los dolores de cabeza, el dolor pélvico crónico y otras afecciones superpuestas.
La sensibilización central según la Asociación Internacional para el Estudio del Dolor no puede evaluarse directamente en humanos, ya que todavía no es posible realizar registros directos de las neuronas centrales mediante métodos electrofisiológicos. Por lo tanto, el término sensibilización central NO debe utilizarse como tal, tanto en la investigación en humanos como en la práctica clínica
SÍNDROME SENSIBILIZACIÓN CENTRAL: NO EXISTE
EL SÍNDROME DE SENSIBILIZACIÓN CENTRAL NO EXISTE- es un error gramatical de concordancia -, al suprimir la “S” final de la terminología SINDROMES DE SENSIBILIZACIÓN CENTRAL, usando un modo suave de decirlo.
SINDROMES → suprime la S final → y aparece la palabra SÍNDROME.
POR LO TANTO, SÍNDROME DE SENSIBILIZACIÓN CENTRAL ES UN NOMBRE, TERMINOLOGIA, O CATEGORIA DIAGNÓSTICA QUE NO EXISTE. SIMPLEMENTE ES UN ERROR GRAMATICAL DE CONCORDANCIA CON LA TERMINOLOGÍA SINDROMES DE SENSIBILIZACIÓN CENTRAL QUE SÍ EXISTE, COMO AGRUPACIÓN DE SÍNDROMES QUE COMPARTEN SÍNTOMAS SUPERPUESTOS.
- Un nombre engañoso puede dar lugar a conceptos y tratamientos engañosos que pueden resultar perjudiciales.
Fue propuesta la hipótesis de que la SC sea el aglutinante fisiopatológico común de los SINDROMES DE SENSIBILIZACIÓN CENTRAL (CSSs)
Existe agrupación de síndromes que comparten síntomas comunes, siendo el dolor persistente la característica más destacada a la que Yunus 1984 sugirió los denominarlos Síndromes de sensibilidad central. Pero NO como UN SÍNDROME DE SENSIBILIZACIÓN CENTRAL (en singular) como entidad aparte, por lo tanto se justifica una gran precaución con respecto a la generalización de la equivoca etiqueta "Síndrome de sensibilización central" pues es una condición que no existe
SÍNDROMES DE SENSIBILIZACIÓN CENTRAL (CSSs)
Es una terminología nueva propuesta por Yunus en 1984, para su hipótesis unificadora de la SC, como aglutinante fisiopatológico de la agrupación de los distintos síndromes de dolor crónico ya existentes (la fibromialgia (FM), el síndrome de fatiga crónica/encefalomielitis miálgica (SFC/EM), el síndrome del intestino irritable, la cistitis intersticial), y que, hasta la fecha, eran y son considerados de manera individual e independiente, aunque con frecuencia tengan algunos síntomas compartidos o superpuestos.
La superposición o solapamiento de los síndromes ya conocidos, indujo a Yunus a agruparlos bajo su nueva terminología SÍNDROMES DE SENSIBILIZACIÓN CENTRAL (CSSs) - observen que lo escribe en plural -, por compartir una serie de características comunes. Pero es de notar que el conjunto de síntomas y la gravedad de los síntomas específicos de cada síndrome varían y, por lo tanto, sería un error perder de vista las diferencias entre estos síndromes específicos, mientras nos centramos en las similitudes.
Si nos atenemos al aspecto de superposición de síntomas de investigaciones comparativas en literatura y clínicas de referencia, se han reportado superposiciones de hasta:
- El 70 % de los pacientes con fibromialgia cumplen con la definición de caso para el síndrome de fatiga crónica y, a la inversa, que entre el 35 % y el 70 % de los pacientes con síndrome de fatiga crónica cumplen con la definición de fibromialgia .
- Además, entre el 13 % y el 18 % de los pacientes con trastorno temporomandibular cumplen los criterios de fibromialgia y el 75 % de los pacientes con fibromialgia satisfacen la definición de caso de trastorno temporomandibular .
- También, entre el 32-80% de los pacientes con FM cumplen con SII (S. intestino irritable) crónica y, a la inversa, que entre el el 32- 65% de los pacientes con SII cumplen los criterios para FM.
De la evidencia científica existente NO surge una imagen coherente de un mecanismo de “sensibilización central” unificador que abarque todos estos síndromes.
Sin embargo, la asociación establecida entre la sensibilización central y los SÍNDROMES DE SENSIBILIZACIÓN CENTRAL (CSSs) fue una extrapolación del razonamiento deductivo.
Respetando los principios fundamentales de la lógica, el argumento presentado no resiste una línea de razonamiento válida o científicamente sólida. Revela un fallo potencial en la deducción, donde premisas generales basadas en estudios preclínicos con modelos animales (sensibilización central) conducen a conclusiones específicas en otra área distinta (presentaciones clínicas CSSs). Dentro de este marco deductivo, puede haber fallos ocasionales a la hora de contemplar todos los modelos potenciales al abordar un problema. Lo que lleva a la inferencia de conclusiones que permanecen en el ámbito de lo posible en lugar de ser definitivamente correctas o precisas.
- Por lo tanto, la aplicación y aceptación tácita de esta premisa (sensibilización central como mecanismo principal de CSSs) siguen siendo notablemente polémica y no demostrada.
- De hecho, en la actualidad carecemos de un método definitivo para establecer y demostrar la presencia de sensibilización central en sujetos humanos.
NO existe un consenso claro sobre todas las condiciones que componen la propuesta teminología de Síndromes de sensibilidad central. Los pacientes con síntomas mal explicados a menudo se incluyen de manera inapropiada en la categoría CSSs.
Por último, el concepto de que los "Síndromes de sensibilidad central" son entidades biológicamente relacionadas NO está firmemente respaldado por la suma de la evidencia de pruebas de neuroimagen. Se observan algunas similitudes pasajeras, pero son superadas con creces por la heterogeneidad y la inconsistencia cuando se comparan los resultados entre trastornos.
De la evidencia científica de técnicas de neuroimágenes existentes, NO surge una imagen coherente de un mecanismo de “sensibilización central” como unificador que abarque estos síndromes: la fibromialgia, síndrome de fatiga crónica, síndrome del intestino irritable, trastorno de la articulación temporomandibular
Lo resultados de la neuroimágenes aplicadas a estos síndromes, comparando los estudios de neuroimagen del: metabolismo basal, la constitución anatómica, los componentes moleculares, la actividad neuronal evocada y el efecto del tratamiento en todos estos síndromes, en este momento, la literatura sobre neuroimagen NO respalda la “sensibilización central” como causa del dolor crónico.
El concepto de varias condiciones y síntomas coexistentes ha sido reconocido por los Institutos Nacionales de Salud con el término “Condiciones de dolor crónico superpuesto”.
La fibromialgia es una de las varias condiciones de dolor crónico superpuesto que a veces se le ha llamado indebida y equivocadamente síndrome de sensibilidad central (que no existe, como han quedado anteriormente explicado).
En 2016, Srbely calificó la SC como un enigma clínico y advirtió que el concepto de los Síndromes de sensibilidad central (CSSs) aún no es lo suficientemente claro y que es necesario estandarizar la terminología.
NO existe un consenso claro sobre todas las condiciones que componen la supuesta terminología de Síndromes de sensibilidad central.
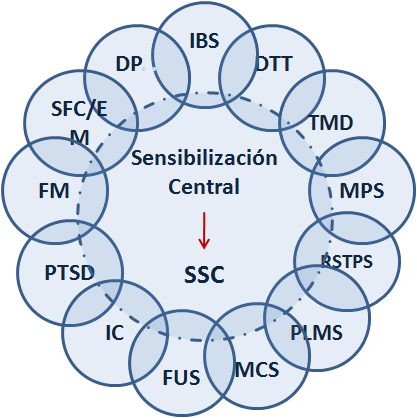
Diagrama de Venn propuesto por Yunus mostrando las condiciones que componen según él, la supuesta terminología de Síndromes de sensibilidad central (CSSs) Se enumeran los integrantes propuestos de los supuestos Síndromes de sensibilidad central con sus relaciones superpuestas y un hipótetico vínculo fisiopatológico común de sensibilización central.
FM: fibromialgia; FC: síndrome de fatiga crónica; SII: síndrome de intestino irritable; DTM: desórdenes temporo-mandibulares; SDM: síndrome de dolor miofascial; MPMS: movimientos periódicos de los miembros durante el sueño; SQM: sensibilidad química múltiple; SUF/CI: síndrome uretral femenino/cistitis intersticial; SSPT: síndrome de estrés postraumático.
- Diagrama de Venn se usa para mostrar gráficamente la agrupación de elementos en conjuntos, representando cada conjunto mediante un círculo, que tienen una zona en común entre los conjuntos, y esta zona se llama intersección (inter).
De lo que llevo explicado puedo concluir que:
- La Sensibilización central (SC) debe considerarse como una hipótesis unificadora utilizada para explicar las condiciones de dolor en humanos, adoptada de estudios con animales
- “Un cuerpo importante de literatura clínica y experimental en humanos interpreta una multitud de síntomas y signos como expresiones de SC, hasta un punto que NO está respaldado por la evidencia de las investigaciones actuales”
- Actualmente, ninguna prueba puede determinar de manera concluyente que una persona tenga sensibilización central
- Actualmente, no hay evidencia que demuestre una sensibilización central (como la descrita por Woolf en ratas), en sujetos humanos, y las herramientas de evaluación actuales para humanos, no son aptas para la medición directa de los fenómenos neurofisiológicos.
- El término sensibilización central NO debe utilizarse como tal, tanto en la investigación en humanos como en la práctica clínica.
TRATAMIENTO DE LA SUPUESTA SENSIBILIZACIÓN CENTRAL
Si la sensibilización central es tan solo una hipótesis no respaldada por la evidencia de las investigaciones actuales, es lógico que no haya ningún tratamiento eficaz y duradero.
Los tratamientos actualmente disponibles para los SC son empíricos, paliativos y tan solo proporcionan sólo beneficios modestos.
El SÍNDROME DE SENSIBILIZACIÓN CENTRAL NO EXISTE, no es una entidad clínica, consecuentemente no existe diagnóstico ni tratamiento.
LOS SÍNDROMES DE SENSIBILIZACIÓN CENTRAL es una propuesta de agrupar síndromes, pero no es tampoco una entidad clínica, por eso no tiene tratamiento
- La fibromialgia se ha considerado por algunos autores como prototipo de sensibilización central. Por ello en la literatura la mayoría de los ensayos clínicos reportados se han realizado en éste síndrome.
Hasta la fecha, las personas con Fibromialgia (y otros síndromes dolorosos) son tratadas con intervenciones que son paliativas, en lugar de curativas.
Los beneficios de los tratamientos farmacológicos en la FM son de relevancia clínica cuestionable y la evidencia de los beneficios de las intervenciones no farmacológicas es limitada.
Actualmente, no existen tratamientos para fibromialgia que alivien por completo los síntomas.
- Además, el hecho de participar en un ensayo clínico y ser estudiado puede conducir a una mejoría sintomática que no es específica de ninguna intervención en particular. La eficacia de cualquiera de los tratamientos utilizados actualmente es modesta.
El problema de la modesta eficacia del tratamiento suele enmascararse con lenguaje estadístico. No es difícil demostrar pequeñas diferencias en los síntomas clínicos a lo largo del tiempo. Si bien las diferencias a menudo no son clínicamente importantes, suelen ser estadísticamente significativas. La notificación de diferencias “significativas” en la notificación del dolor que son clínicamente irrelevantes puede ser engañosa.
- Sesgo en el leguaje estadístico: Es un defecto en el diseño de un estudio de investigación científica o ensayo clínico, o en el método usado para recopilar o interpretar la información. Los sesgos pueden conducir a conclusiones incorrectas acerca de los resultados del estudio o el ensayo clínico.
CONCLUSIONES
- La gran confusión se origina al fusionar síndromes clínicos distintos como : fibromialgia, síndrome de fatiga crónica, síndrome de intestino irritable, desórdenes temporomandibulares, y sustituirlos por el nuevo término de SÍNDROME DE SENSIBILIDAD CENTRAL (en singular), que NO existe.
- EL SÍNDROME DE SENSIBILIZACIÓN CENTRAL ES UN NOMBRE, TERMINOLOGIA, O CATEGORIA DIAGNÓSTICA QUE NO EXISTE - es un error gramatical de concordancia-, al suprimir la “S” final de la terminología SINDROMES DE SENSIBILIZACIÓN CENTRAL, usando un modo suave de decirlo. SINDROMES → suprime la S final → y aparece la palabra SÍNDROME.
- SÍNDROMES DE SENSIBILIZACIÓN CENTRAL EXISTE COMO AGRUPACIÓN DE SÍNDROMES QUE COMPARTEN SÍNTOMAS SUPERPUESTOS, PERO NO COMO ENTIDAD CLÍNICA.
- La aplicación y aceptación tácita de esta premisa − (sensibilización central como mecanismo principal de los Síndromes de sensibilización central (CSSs) −, sigue siendo notablemente polémica y no demostrada. El término sensibilización central NO debe utilizarse como tal, tanto en la investigación en humanos como en la práctica clínica
- La fibromialgia se ha considerado por algunos autores como prototipo de sensibilización central. Actualmente, no existen tratamientos para fibromialgia que alivien por completo los síntomas.
REFERENCIAS
- Párraga JP, Castellanos A. A Manifesto in Defense of Pain Complexity: A Critical Review of Essential Insights in Pain Neuroscience. J Clin Med. 2023 Nov 14;12(22):7080. doi: 10.3390/jcm12227080. PMID: 38002692; PMCID: PMC10672144.
- Yunus MB. Central sensitivity syndromes: a new paradigm and group nosology for fibromyalgia and overlapping conditions, and the related issue of disease versus illness. Semin Arthritis Rheum. 2008 Jun;37(6):339-52. doi: 10.1016/j.semarthrit.2007.09.003. Epub 2008 Jan 14. PMID: 18191990.
- Pinto, AM, Geenen, R., Wager, TD et al. Emotion regulation and the salience network: a hypothetical integrative model of fibromialgia. Nat Rev Rheumatol 19, 44–60 (2023). https://doi.org/10.1038/s41584-022-00873-6
- Walitt B, Ceko M, Gracely JL, Gracely RH. Neuroimaging of Central Sensitivity Syndromes: Key Insights from the Scientific Literature. Curr Rheumatol Rev. 2016;12(1):55-87. doi: 10.2174/1573397112666151231111104. PMID: 26717948; PMCID: PMC4785050.
- Adams LM, Turk DC. Psychosocial factors and central sensitivity syndromes. Curr Rheumatol Rev. 2015;11(2):96-108. doi: 10.2174/1573397111666150619095330. PMID: 26088211; PMCID: PMC4728142.
PROF. DR. FERNANDO GALAN