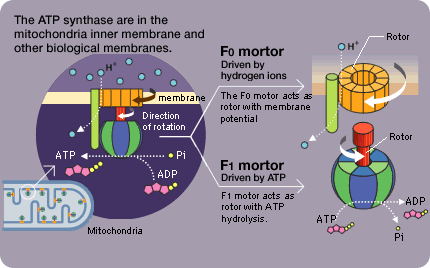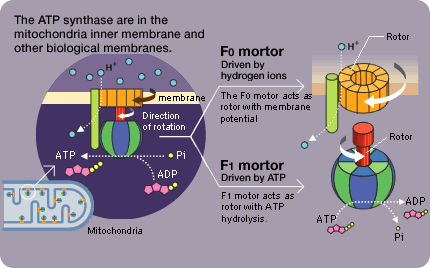
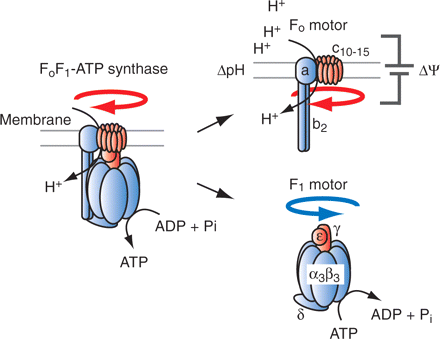
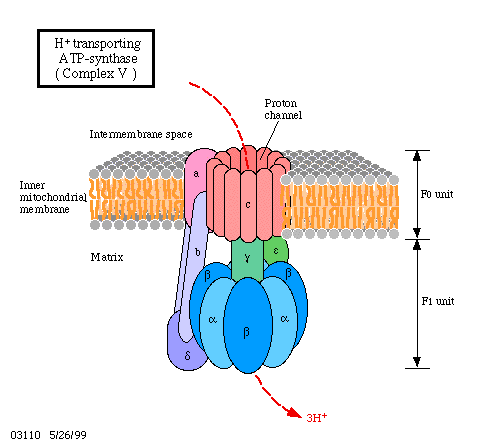
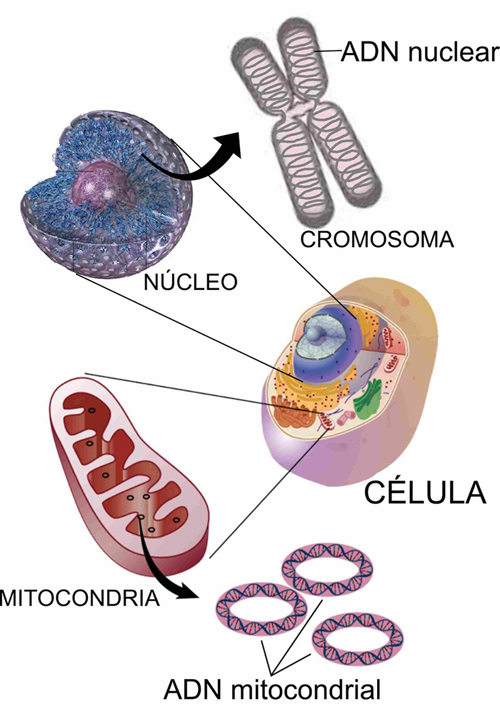
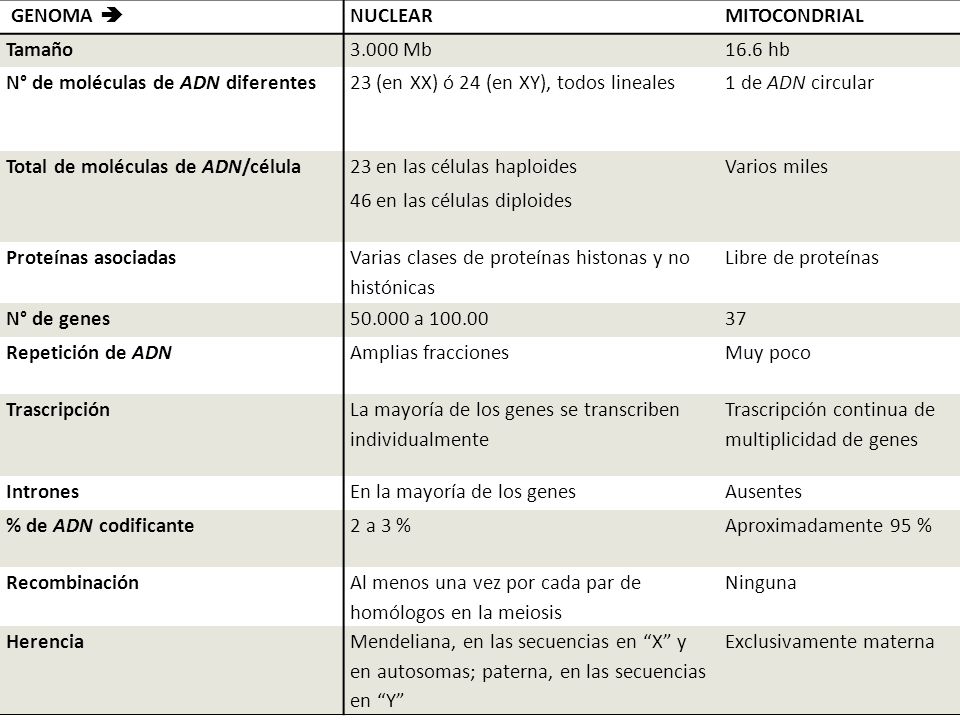
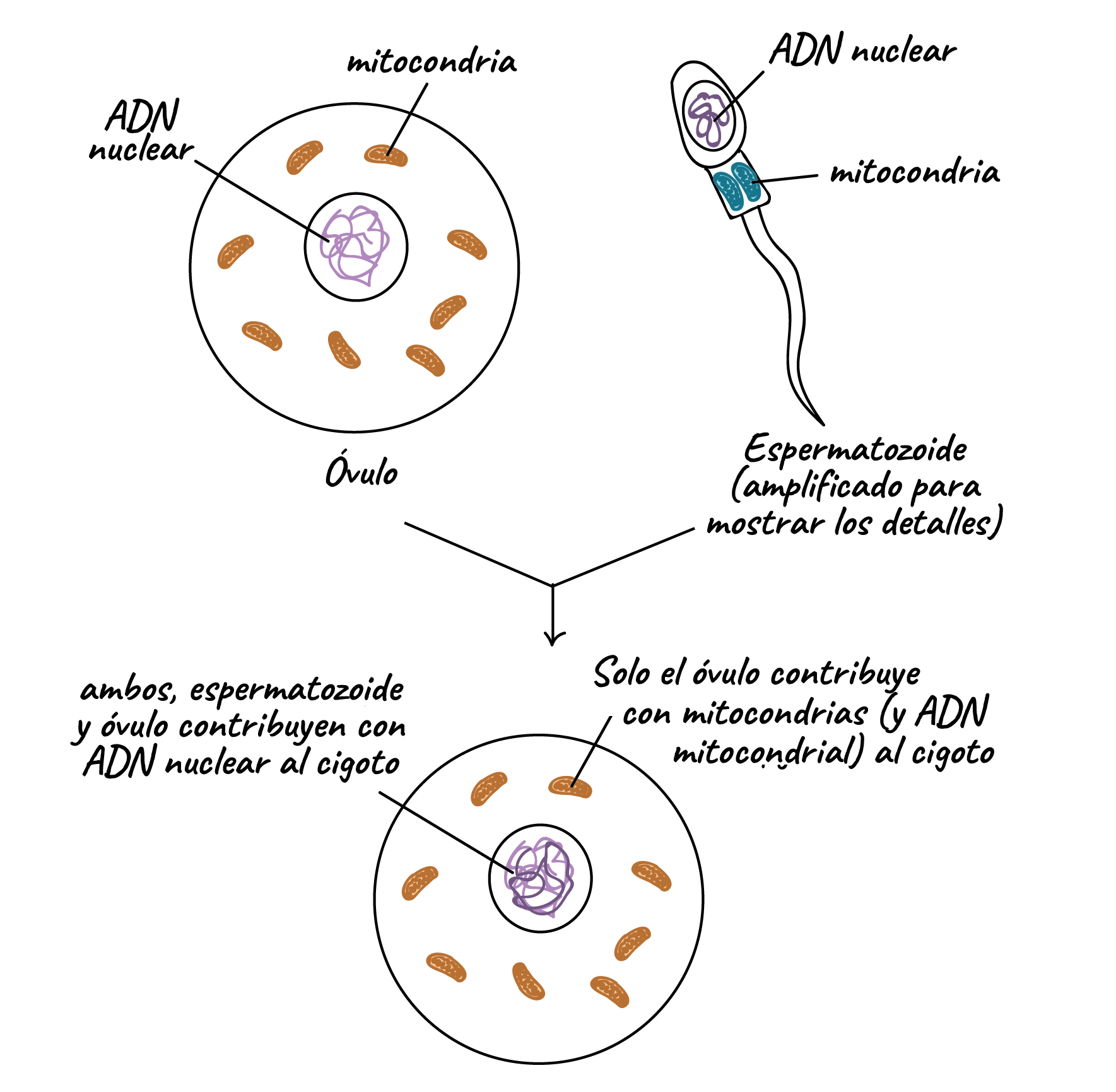
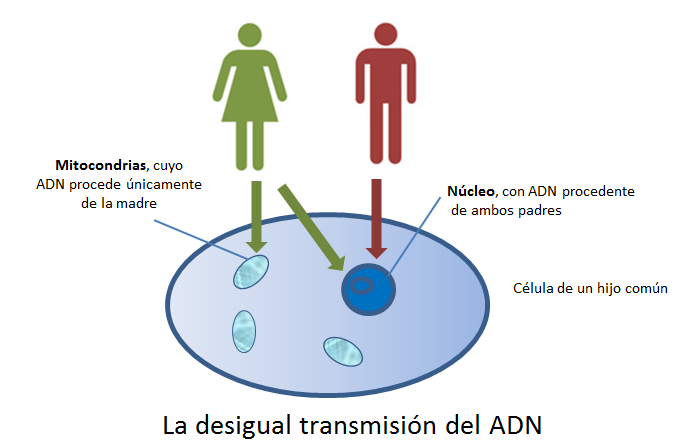
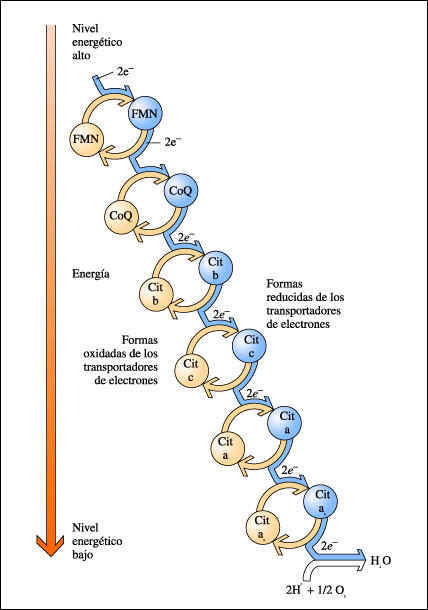
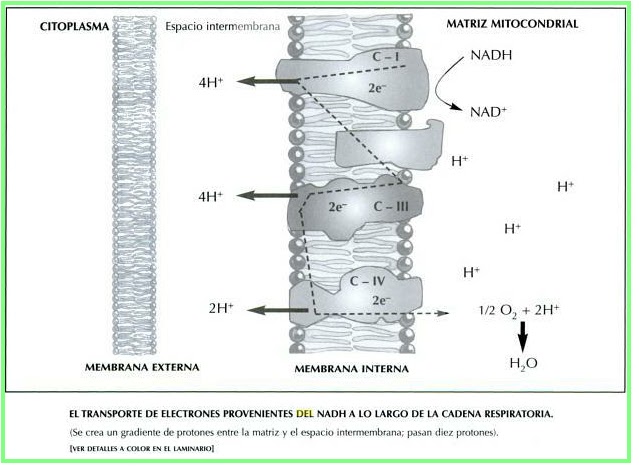
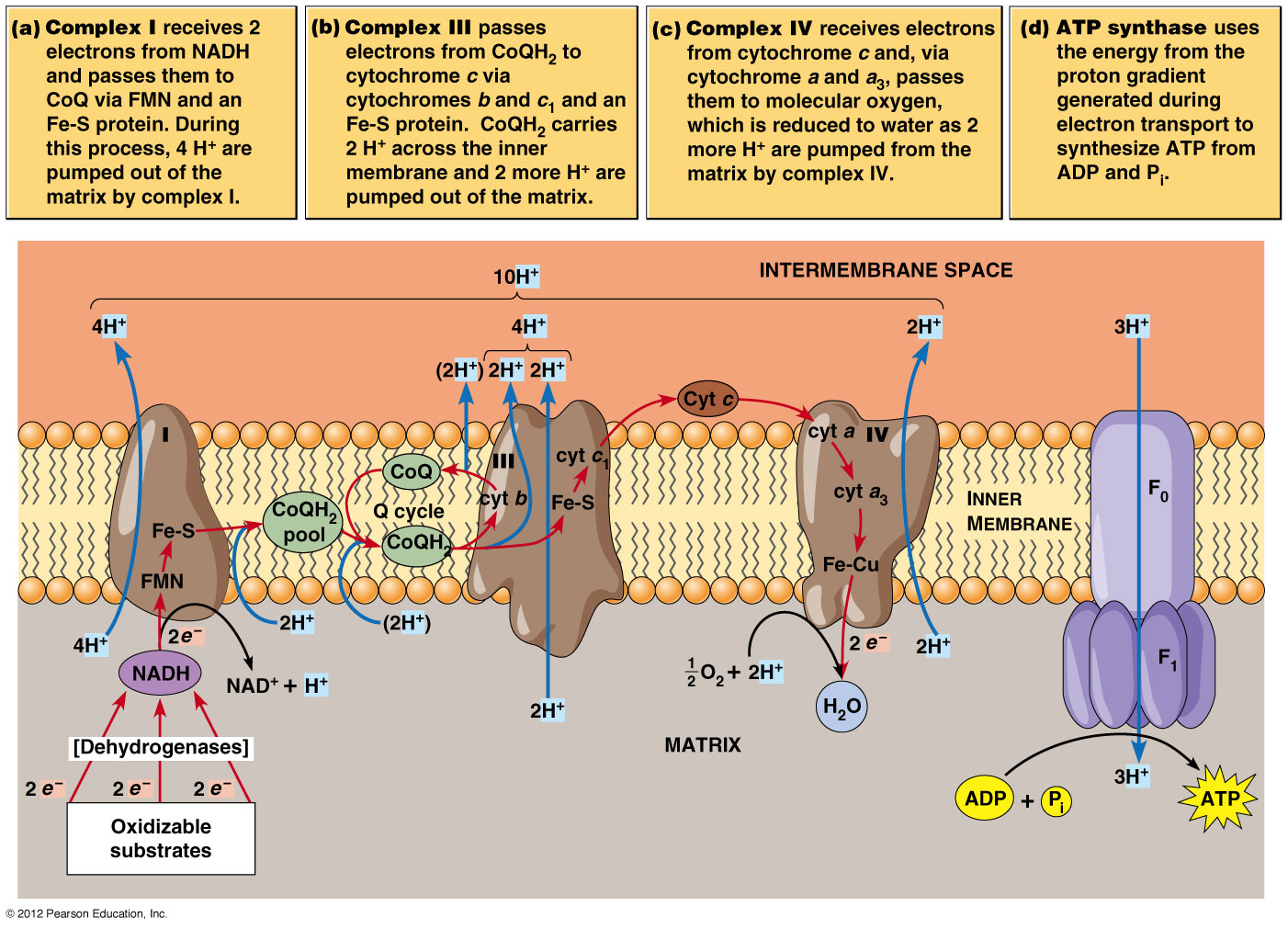
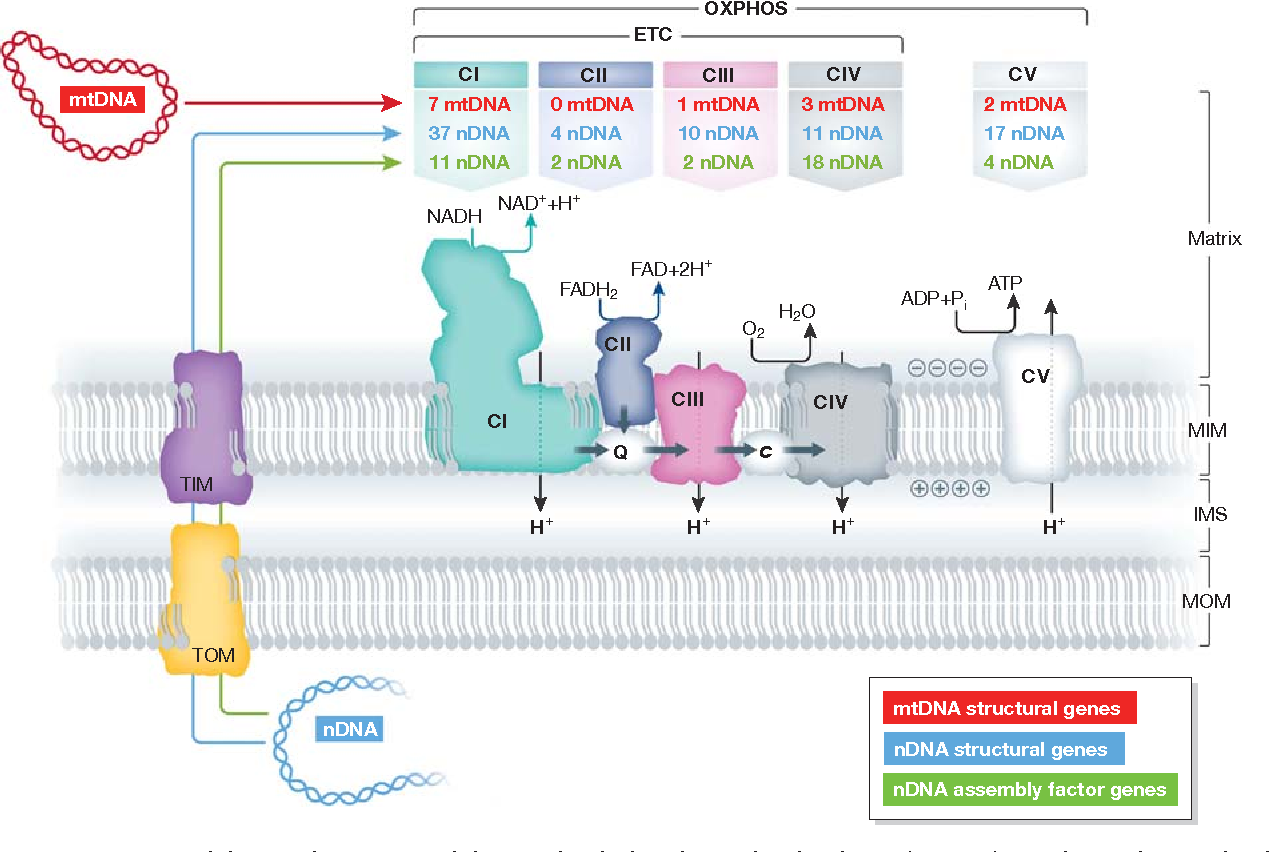
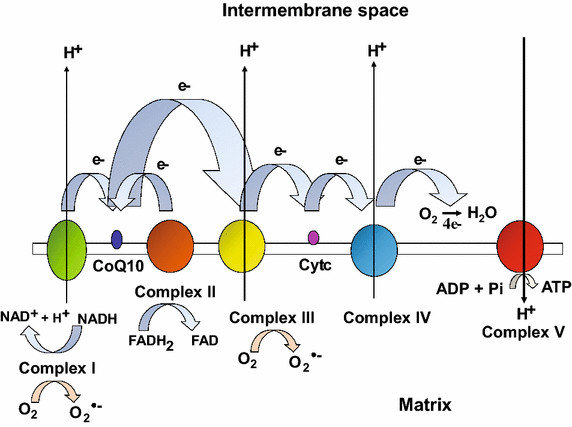
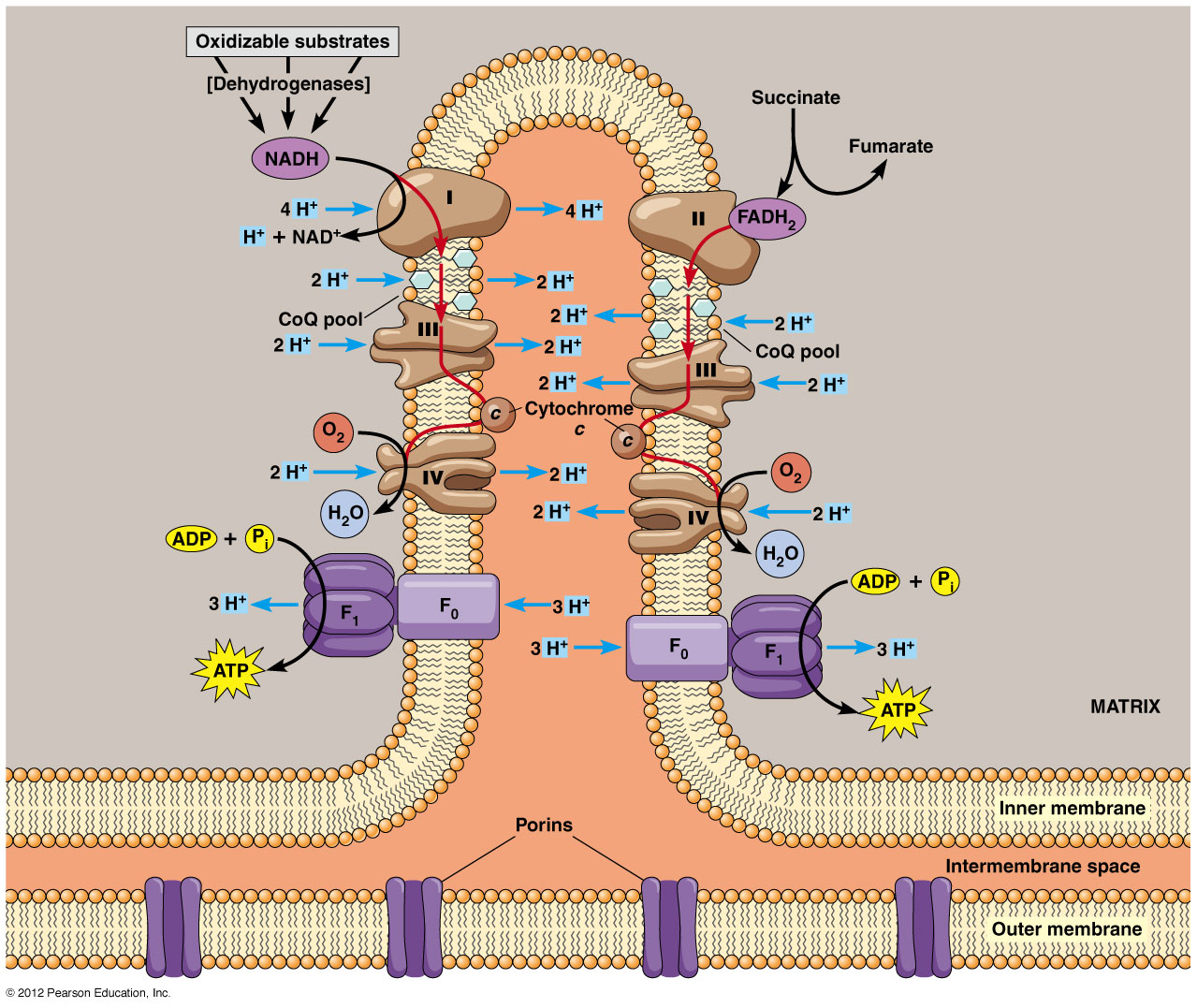
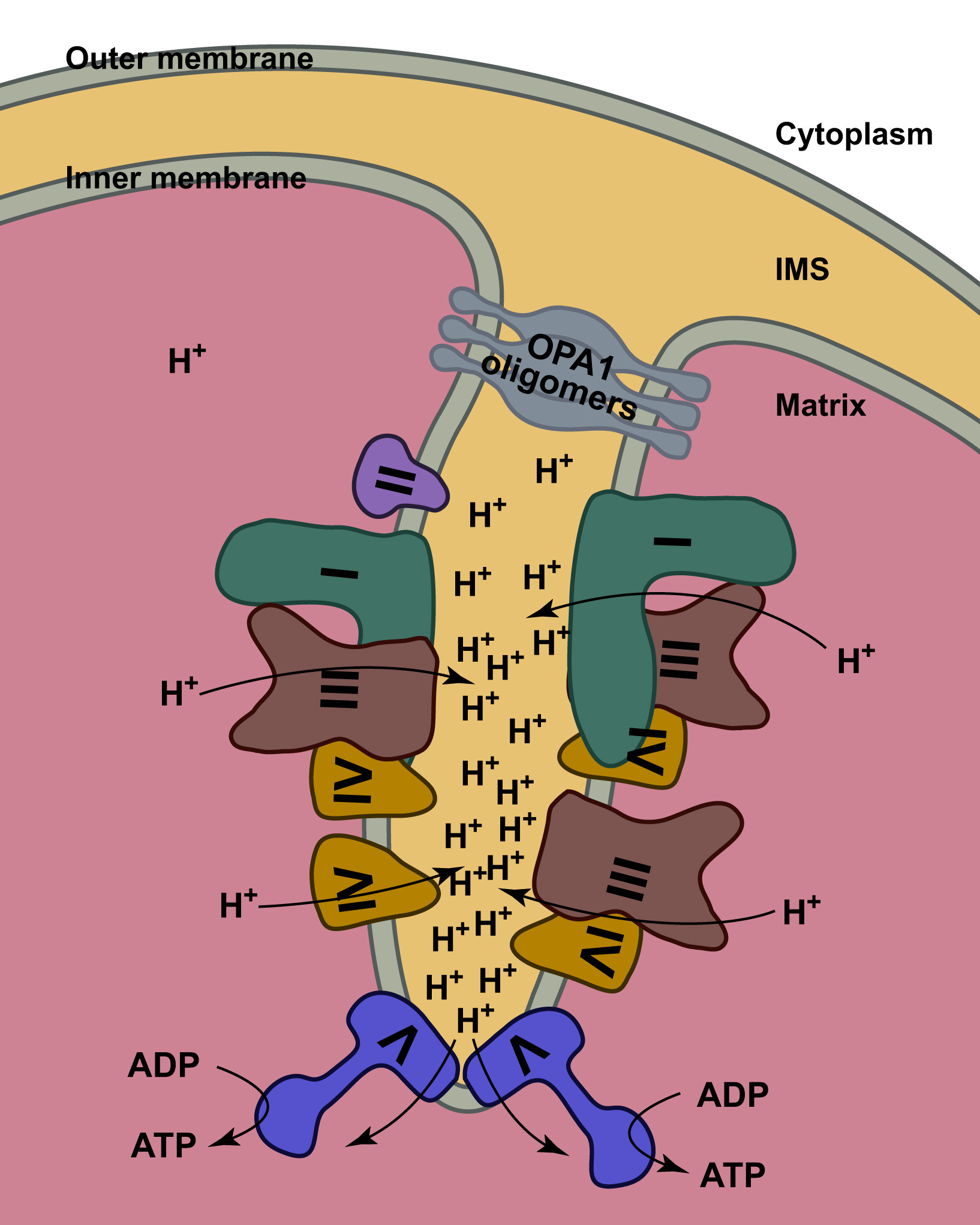
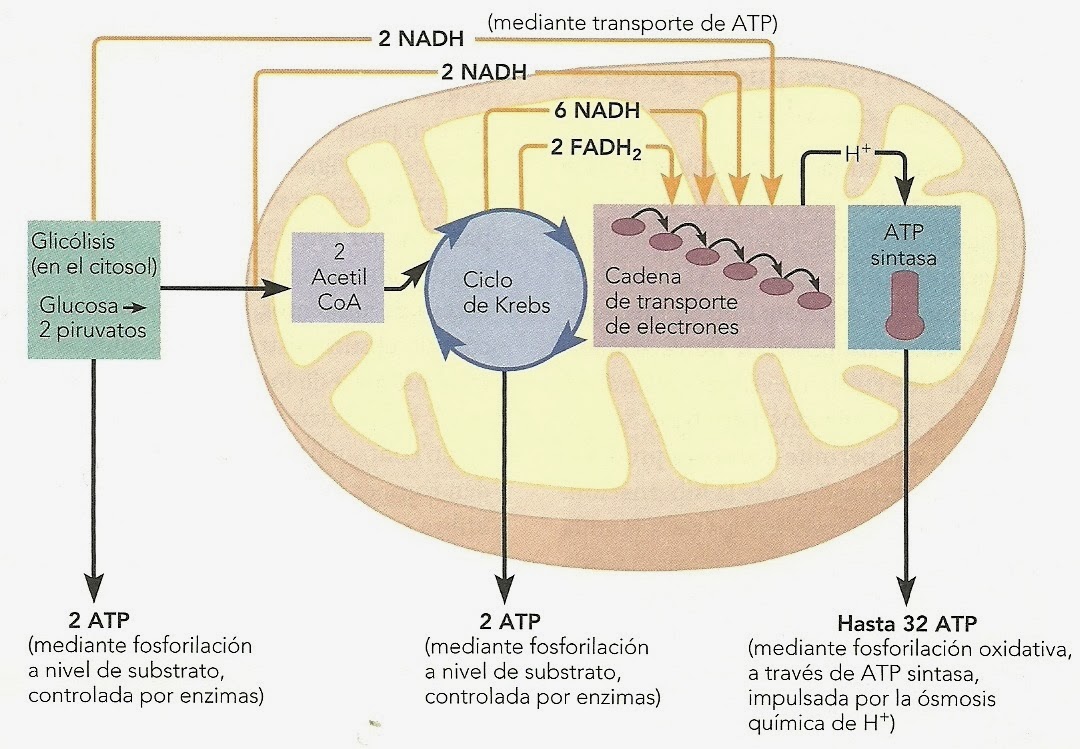
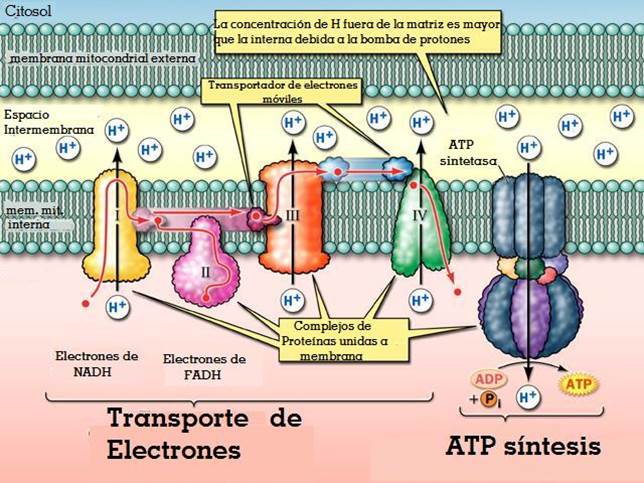
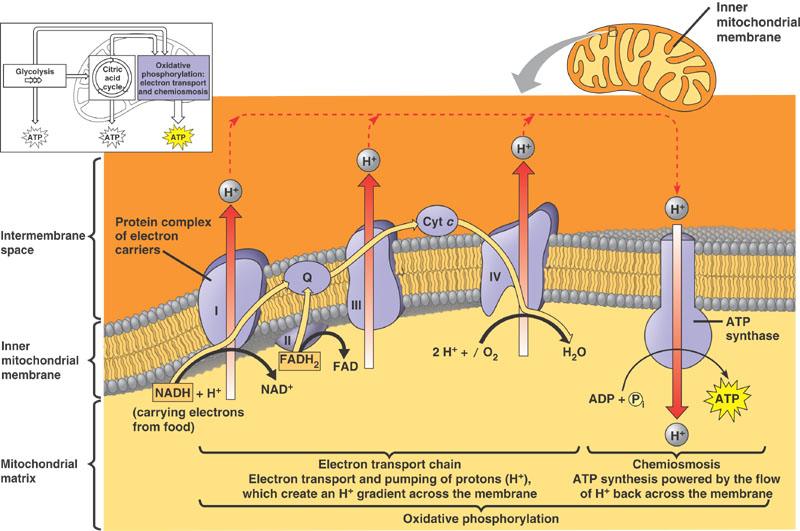
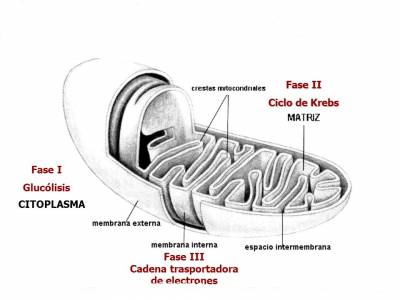
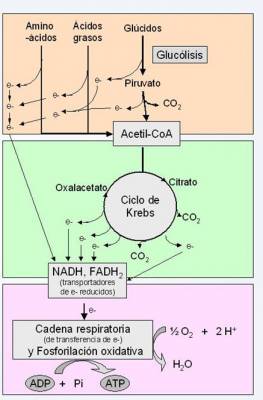
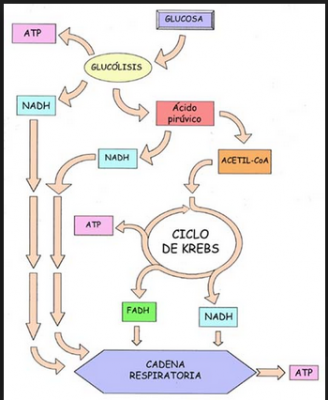
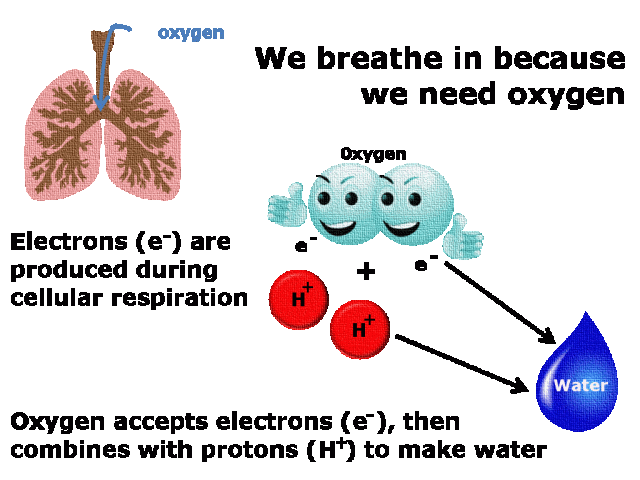El estándar de oro para el diagnóstico de enfermedad mitocondrial es realizar pruebas genéticas, aunque sigue siendo un proceso costoso que a menudo no está cubierto por los planes de salud.
Sin embargo, las mejoras en el perfil clínico y molecular de la enfermedad mitocondrial combinadas con el avance de nuevas técnicas moleculares están mejorando el diagnóstico de la enfermedad mitocondrial.
Pero es posible que muchos pacientes puedan ser diagnosticados de enfermedad mitocondrial basado únicamente en los hallazgos clínicos y / o bioquímicos, sin una mutación genética que pueda ser identificada.
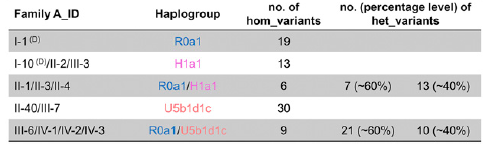
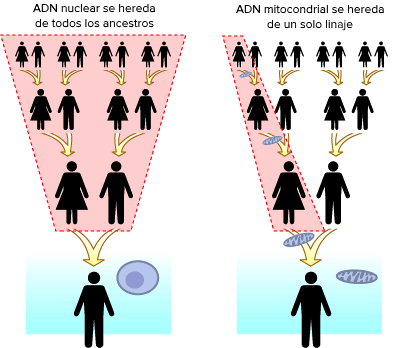
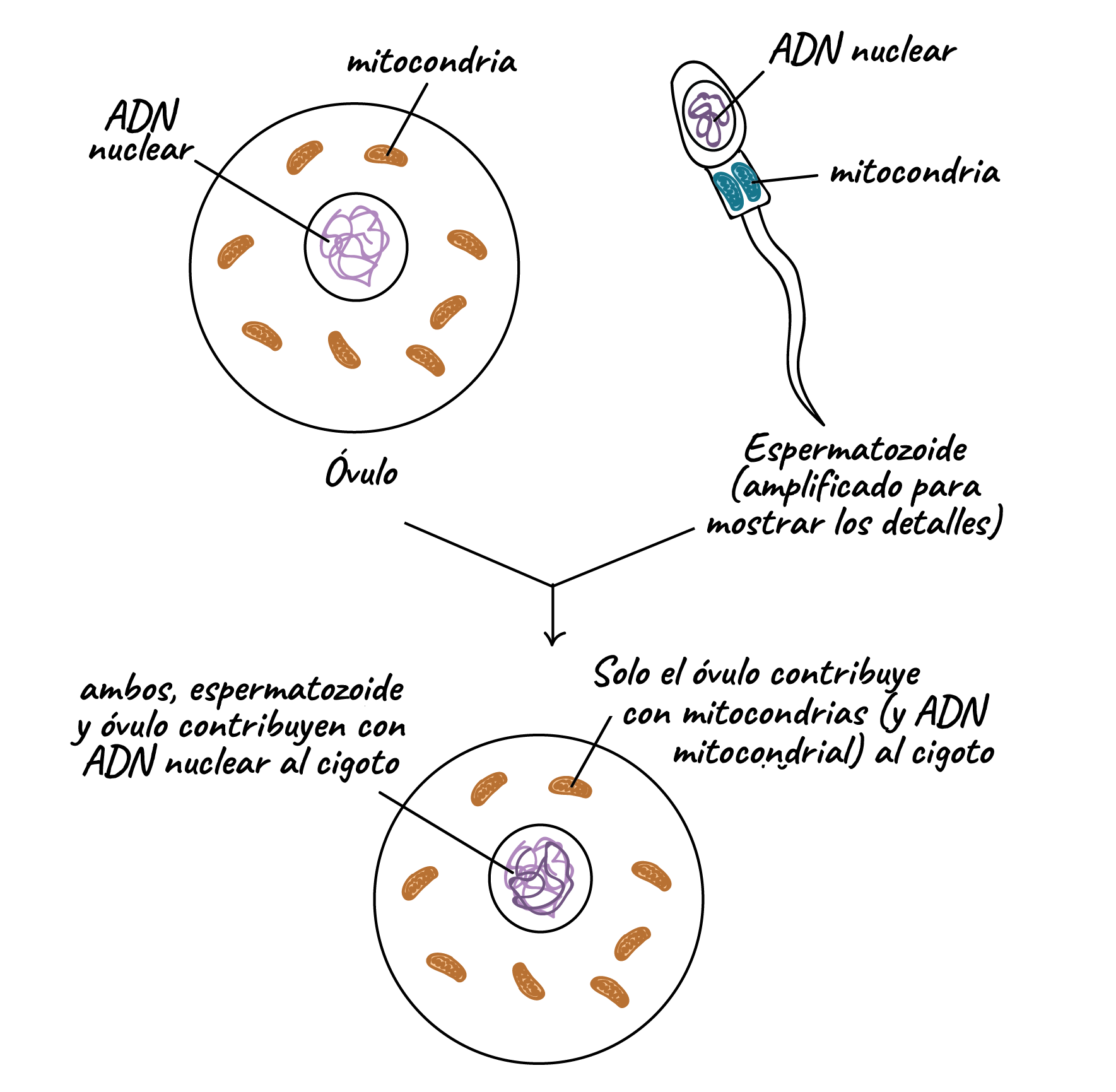
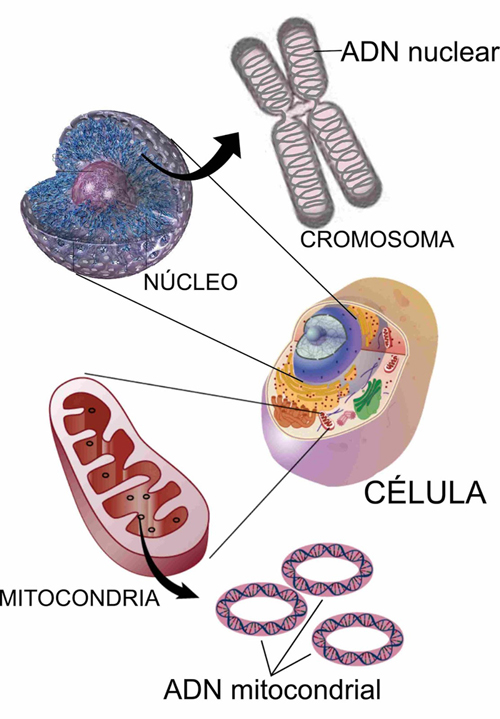
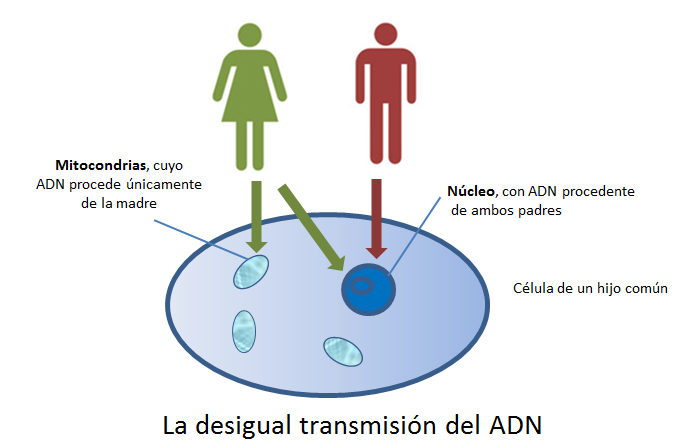
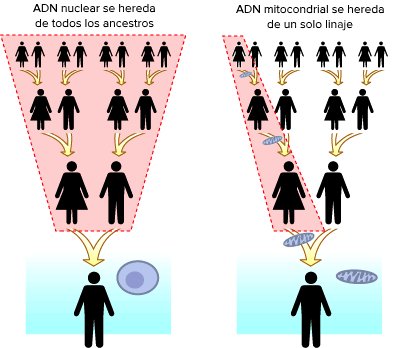
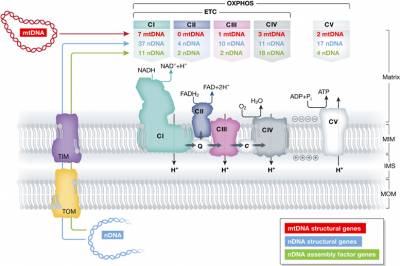
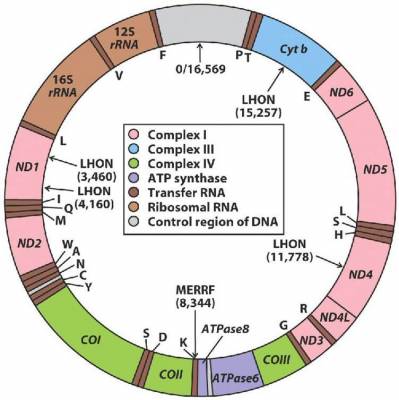
El nivel de heteroplasmia, o la mezcla de ADN mitocondrial patógeno y normal en una célula contribuye a la variabilidad en la presentación clínica de la enfermedad mitocondrial. En el transcurso de la vida, la proporción de ADN mitocondrial normal y mutante dentro de una célula o tejido puede cambiar. Y podría ayudar a explicar las presentaciones graves que ocurren antes del nacimiento y primeros meses-años en la vida (con una alta carga de mutantes), junto a las mutaciones en el ADN nuclear ≈ 80%;
Y la enfermedad mitocondrial de inicio tardío – adultos - (mutaciones ADN mitocondrial ≈ 75%), donde los pacientes pueden estar en general bien de salud hasta que desarrollen signos de enfermedad (menor carga mutante).
Los pacientes con enfermedad mitocondrial tienden a requerir múltiples médicos y especialistas en su equipo de atención y son más susceptibles a descompensaciones que requieren intervenciones médicas.
La enfermedad mitocondrial puede presentarse a cualquier edad, aunque el diagnóstico infantil está asociado con la mayor gravedad y probabilidad de muerte. Los niños (edad media de 7,4 años) representan casi la mitad de la población de enfermedad mitocondrial. Dada la naturaleza crónica, compleja y debilitante de la enfermedad, es probable que los pacientes con enfermedad mitocondrial de todas las edades necesiten de múltiple atención médica y de especialistas, y tengan una mayor dependencia de los servicios de hospitalización, emergencia y cirugía, y necesiten de más medicamentos recetados que la población general.
Estos investigadores realizaron un estudio retrospectivo para explorar la utilización de asistencia sanitaria por los pacientes diagnosticados con enfermedades mitocondriales en los EE.UU.
Los datos se obtuvieron de las bases de datos de fuentes de las Guías de costos de salud consolidados de Truven Health Analytics MarketScan y Milliman, correspondientes a personas con seguro comercial desde 2008 hasta 2015..
Características demográficas y clínicas de los pacientes con ENFERMEDAD MITOCONDRIAL
|
Características |
Pediátrica |
Adulta |
|
Población, n (%) |
3.790 (46.3) |
4.390 (53.7) |
|
Edad en años, media |
7.4 |
42.3 |
|
Género, n |
||
|
Mujer (n = 4.348) (%) |
1.605 (36.9) |
2.743 (63.1) |
|
Hombre (n = 3.832) (%) |
2.185 (57.0) |
1.647 (43.0) |
- edades entre 0 y 15 años (pediátricos)
- edades de 16 años o más (adultos)
La discrepancia de género podría estar relacionada con que las mujeres adultas con herencia mitocondrial materna tengan un mayor riesgo de desarrollar síntomas en comparación con los padres varones. Además, las mujeres pueden estar más afectadas por comorbilidades complejas comunes que se diagnostican erróneamente de ENFERMEDAD MITOCONDRIAL como– fibromialgia, síndrome de fatiga crónica - .
La escasez de especialistas en metabolismo destaca la necesidad de que tanto el médico de atención primaria como los especialistas reconozcan las presentaciones clínicas comunes de la enfermedad mitocondrial y evalúen o deriven a los pacientes con síntomas sospechosos para un diagnóstico adicional específico de la enfermedad mitocondrial.
Principales especialidades médicas con mayor utilización de recursos en adultos con ENFERMEDAD MITOCONDRIAL
- La medicina interna con aumento de 4.4 veces sobre la población general
- la medicina general con aumento de 11.3 veces sobre la población general
- la medicina de familia con aumento de 2.0 veces sobre la población general
Representando estas 3 especialidades médicas el 44% de la utilización de recursos en el ámbito médico para adultos.
Principales especialidades médicas con mayor utilización de recursos en pacientes pedriáticos con ENFERMEDAD MITOCONDRIAL
- la pediatría aumento de 5.4 veces sobre el total de la población pediátrica
- la medicina general aumento de 5.3 veces sobre el total de población pediátrica
- la neurología aumento de 52.0 veces sobre el total de población pediátrica
Representando estas 3 especialidades médicas el 39% de la utilización total de recursos
El aumento en la utilización de recursos es una consecuencia de la gestión de la naturaleza compleja de ENFERMEDAD MITOCONDRIAL .
El costo total por miembro por mes (PMPM) para:
- pacientes pediátricos fue de $ 4.829 en comparación con un promedio de $ 202 para la población total general, correspondientes a todas las personas aseguradas.
- pacientes adultos fue de $ 3100, en comparación con un promedio de $ 486 para la población total.
En la población adulta, la ENFERMEDAD MITOCONDRIAL supone una carga de costo de PMPM que fue comparable a la observada para pacientes:
- con esclerosis múltiple ($ 3.518)
- y Esclerosis lateral amiotrófica (ELA) ($ 3.460).
Aunque el costo de los medicamentos recetados es el mayor impulsor de la utilización de recursos, lo que representa el 31% del uso total de los recursos de atención de salud, su influencia en el costo de la ENFERMEDAD MITOCONDRIAL es solo del 15%,
- probablemente debido a la falta de un tratamiento de prescripción aprobado por la FDA para la MD.
Los anticonvulsivos fueron la clase de medicamento más recetada para los pacientes con ENFERMEDAD MITOCONDRIAL.
Los opioides y relajantes musculares representaron el 4 y el 2% de los medicamentos recetados para adultos, respectivamente
Los modificadores metabólicos, que fueron la segunda clase de medicamentos más prescritos para pediatría, incluyen varios suplementos dietéticos como
- L-carnitina que sirve como lanzadera mitocondrial para los ácidos grasos,
- Coenzima Q10 un aceptador de electrones necesario para una función mitocondrial adecuada.
La tercera clase de medicación más prescrita para la ENFERMEDAD MITOCONDRIAL pediátrica y adulta fue la de los inhibidores de la bomba de protones, que generalmente se usan para la enfermedad por reflujo gastroesofágico
Otros costos de terapia que NO se cuantifica es el uso de: vitaminas, suplementos nutricionales y otros medicamentos de venta libre.
CONCLUSIONES
- La utilización de asistencia sanitaria de pacientes con enfermedad mitocondrial es mucho más cara que la de la población general
- La población estudiada retrospectivamente fue: 790 (46,3%) pacientes pediátricos, edades desde recién nacidos hasta los 15 años; y 4,390 (53.7%) pacientes adultos, mayores de 16 años.
- La escasez de especialistas en metabolismo destaca la necesidad de que tanto el médico de atención primaria como los especialistas reconozcan las presentaciones clínicas comunes de la enfermedad mitocondrial
- Para los pacientes adultos, los costos fueron $ 3,100 similares a los de los pacientes con esclerosis múltiple ($ 3,518 por paciente, por mes) y esclerosis lateral amiotrófica ELA ($ 3,460 por paciente, por mes).
REFERENCIAS
Bruce Cohen et al. A retrospective analysis of health care utilization for patients with mitochondrial disease in the United States: 2008–2015. Orphanet Journal of Rare Diseases, 13(1), 210, 2018
Resumido y traducido por Prof. Dr. Fernando Galan