La historia de las enfermedades mitocondriales es un área de la medicina fascinante, en constante evolución y en continuo desconcierto.
DIFICULTADES Y ERRORES COMUNES ACTUALES
- Las enfermedades mitocondriales alguna vez fueron relegados a la condición de “huérfanas” como temas de pequeños párrafos en los libros de texto de patología y en las prácticas hospitalarias de los subespecialistas. Con la creciente apreciación de la alta frecuencia observada tanto en la atención primaria como especializada, merece la atención de todos los médicos en ejercicio. Desafortunadamente, los profesionales médicos que ejercen actualmente, a menudo se basan en la información que se les proporcionó durante su formación en las Facultades de medicina y formación como especialistas ; esta información solía estar incompleta y ahora está desactualizada. A muchos nuevos médicos jóvenes que saben un poco más sobre la Enfermedad, a menudo todavía creen que todos los tipos de Enfermedades mitocondriales son extremadamente raros y piensan que es poco probable que vean un caso en su vida.
- "Lo que no se sabe o lo que no se piensa no se diagnostica" se puede aplicar al diagnóstico de enfermedad mitocondrial. Si el medico no piensa que un paciente pude tener una enfermedad mitocondrial nunca la diagnosticará
- Continuar pensando que SOLO tienen enfermedad mitocondrial aquellos pacientes que tiene algún Síndrome clásico.
- Continuar pensado que solo afecta a la edad infantil
- Continuar pensado que se diagnostican si cumple todos los criterios diagnósticos
- Continuar pensando que la negatividad de distintas pruebas pueden descartar la enfermedad.
La enfermedad mitocondrial primaria (EMP) se hereda y diagnostica genéticamente mediante la identificación de mutaciones en el ADN mitocondrial (ADNmt) o ADN nuclear (ADNn) que provocan disfunción mitocondrial. Las EMP pueden ocurrir debido a mutaciones de la línea germinal de genes del ADNmt y / o ADNn que codifican proteínas de la cadena respiratoria mitocondrial (CRM) o cadena de transporte de electrones (CTE). Pueden producirse mutaciones puntuales en cualquiera de los 37 genes del ADNmt que codifican 13 proteínas o en los 1.000 genes del ADNn, que son esenciales para la función óptima de la cadena respiratoria mitocondrial (CRM) o cadena de transporte de electrones (CTE).
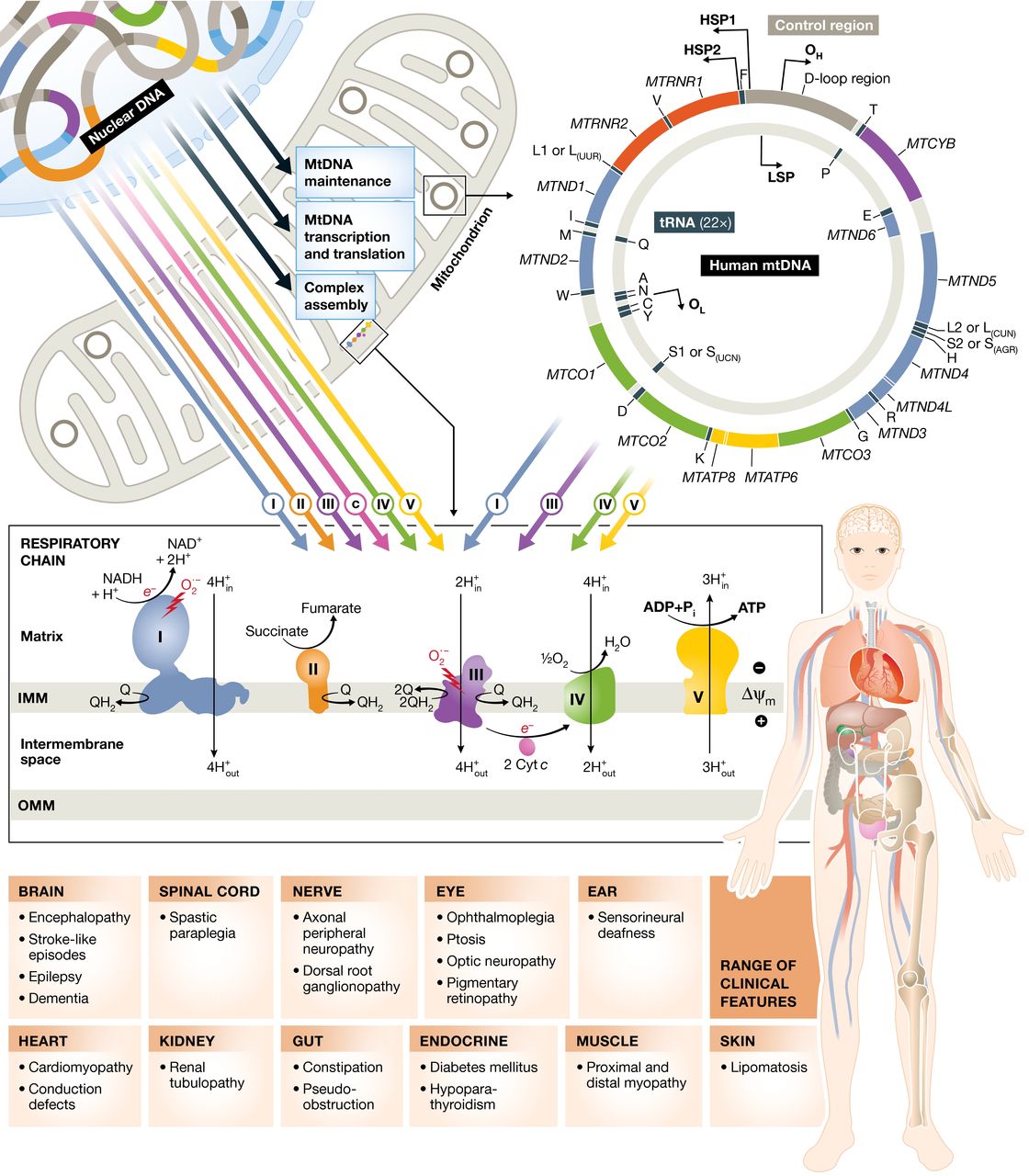
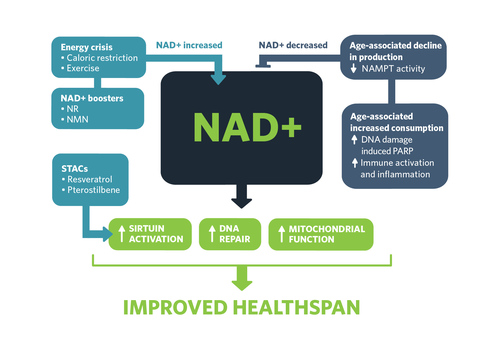
Panel superior: el trifosfato de adenosina (ATP) se genera mediante el proceso de fosforilación oxidativa. Esto se logra mediante la acción concertada de ≈ 90 proteínas dispuestas en cinco complejos de cadenas respiratorias en la membrana mitocondrial interna. Trece de estas proteínas están codificadas por el genoma mitocondrial (mtDNA, derecha), que está presente en un alto número de copias en la matriz mitocondrial (de 100 a 1000 por célula, según el tipo de célula). Las proteínas mitocondriales restantes se sintetizan en el citoplasma a partir de transcripciones de genes nucleares (izquierda) e incluyen las subunidades estructurales restantes; factores de ensamblaje complejos; proteínas implicadas en la replicación, mantenimiento y expresión del mtDNA; y componentes funcionales y estructurales de la membrana mitocondrial. Las mutaciones en los genes que codifican todas estas proteínas pueden causar enfermedades mitocondriales.
Panel inferior: la gama de características clínicas varía de un paciente a otro. Algunos tienen solo una o algunas de las características enumeradas, mientras que otros pacientes tienen muchas en una enfermedad multisistémica. Aunque algunos defectos genéticos causan fenotipos específicos (por ejemplo, las mutaciones del ADNmt que causan la neuropatía óptica hereditaria de Leber, que afecta principalmente a un solo tipo de célula en la gran mayoría de los pacientes), otros defectos genéticos causan un espectro superpuesto de fenotipos que pueden ser causados por ADNmt y/o Mutaciones del ADN nuclear. Las razones de la selectividad del tejido no se comprenden bien.
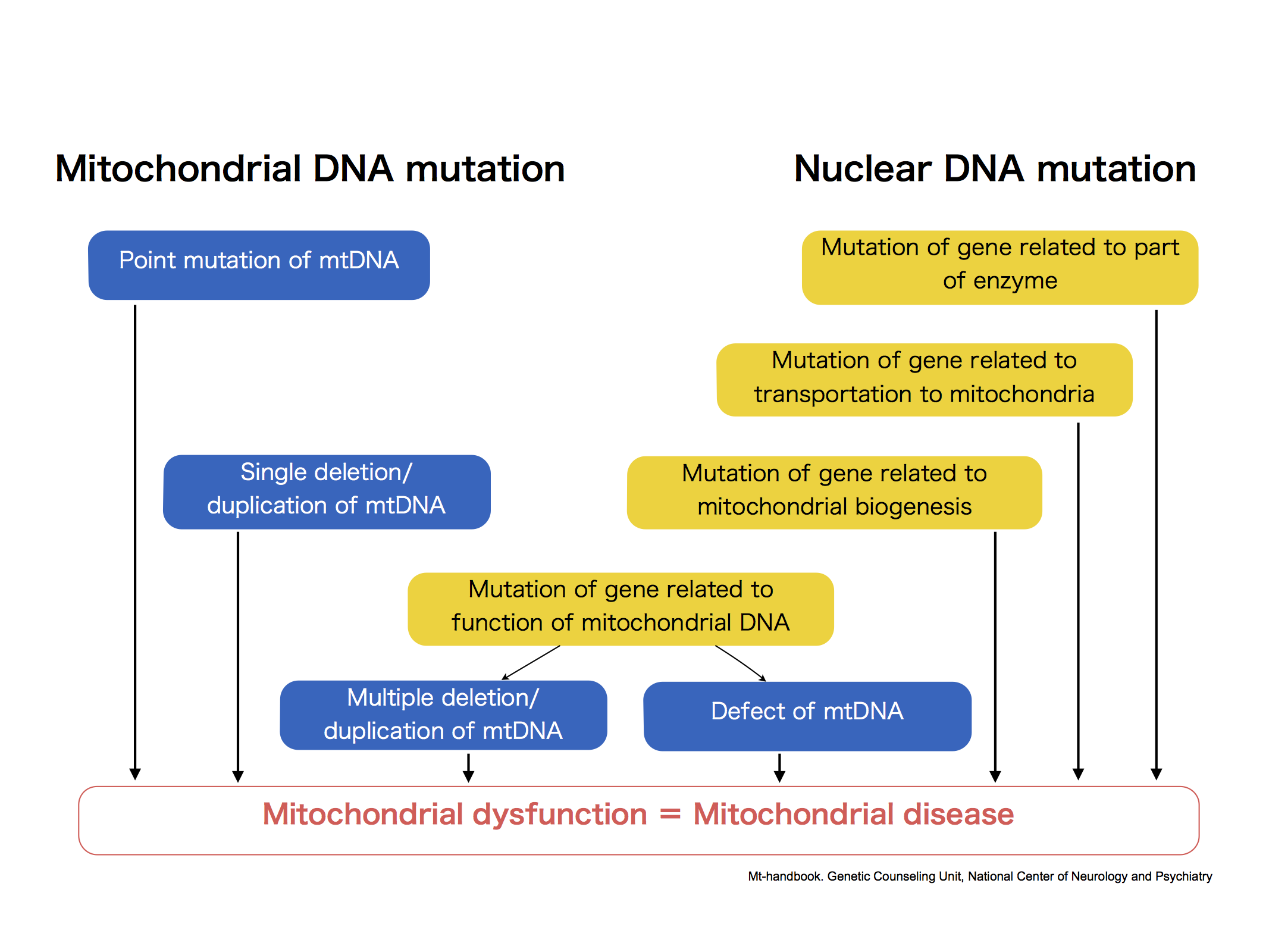
En general, los defectos del metabolismo de la energía mitocondrial se pueden agrupar en las siguientes cinco categorías:
- Defectos aislados de subunidades de OXPHOS o factores de ensamblaje.
- Defectos de la síntesis de ADN, ARN y proteínas mitocondriales (incluida la replicación, el metabolismo de los nucleótidos, el procesamiento y modificación del ARN y la traducción).
- Trastornos en las reacciones anteriores de OXPHOS (complejo de piruvato deshidrogenasa, ciclo de Krebs, beta-oxidación de ácidos grasos, importación de sustrato y anaplerosis)."Anaplerosis": Obtención de intermediarios para el ciclo de Krebs distintos al acetilCoA
- Defectos en los cofactores de OXPHOS y otras enzimas del metabolismo de la energía mitocondrial.
- Defectos en la homeostasis de las mitocondrias, incluyendo su biogénesis, procesamiento de lípidos, importación de proteínas, fisión / fusión y control de calidad
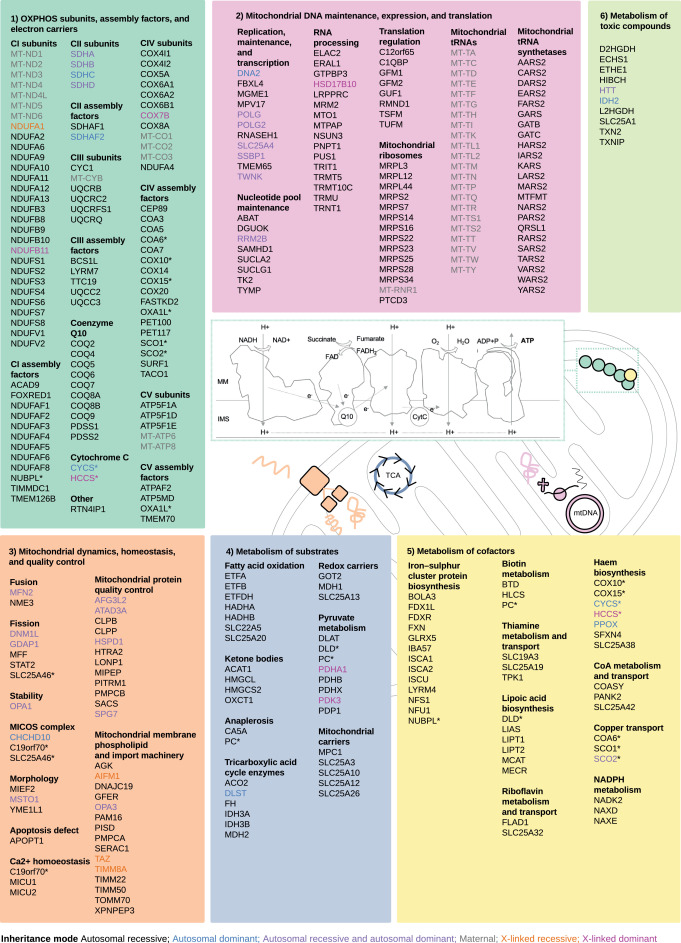
Genes de enfermedades mitocondriales (338) divididos en seis subconjuntos de acuerdo con sus roles funcionales:
- subunidades de OXPHOS, factores de ensamblaje y portadores de electrones (102/338 genes),
- mantenimiento, expresión y traducción del ADN mitocondrial (102/338 genes),
- dinámica mitocondrial, homeostasis y control de calidad (43/338 genes),
- metabolismo de sustratos (40/338 genes),
- metabolismo de cofactores (41/338 genes)
- metabolismo de compuestos tóxicos (10/338 genes).
La medicina mitocondrial es una subespecialidad relativamente joven. El primer paciente con una enfermedad mitocondrial no fue diagnosticado hasta 1962 (LUFT et al., 1962). Durante los últimos veinte años se ha desarrollado un mayor interés en las enfermedades mitocondriales a nivel de investigación y después a nivel clínico.
La práctica clínica de la medicina mitocondrial como especialidad ha evolucionado y se ha expandido gradualmente durante estos últimos 20 años. Debido al joven estado de la ciencia en este campo, los médicos tienen una base de evidencia limitada sobre la cual formular decisiones clínicas con respecto a su diagnóstico, tratamiento y manejo diario del paciente.
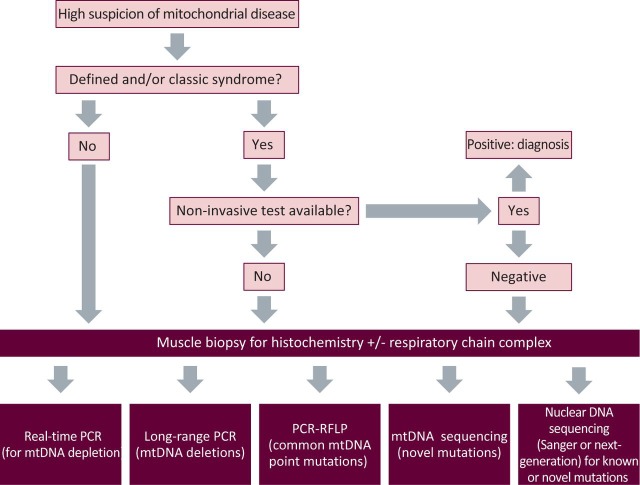
- Los algoritmos de diagnóstico hasta la fecha se han basado principalmente en pruebas bioquímicas y se han visto obstaculizados por limitaciones que incluyen poca sensibilidad, especificidad y variabilidad entre laboratorios.
Los trastornos mitocondriales carecen de biomarcadores específicos y los fenotipos (o manifestaciones clínicas) de las enfermedades son variados. Además, todavía queda la cuestión de ¿cuántas pruebas de diagnóstico son absolutamente necesarias para confirmar o excluir la enfermedad?, y el diagnóstico a menudo requería una combinación de pruebas de sangre, orina, piel, músculo.
A pesar de este arsenal de métodos, la evaluación diagnóstica para la identificación de EM no es estándar en todos los médicos, centros médicos, hospitales o instituciones.
La determinación de SÍ la Enfermedad Mitocondrial está presente o puede ser excluida en un paciente determinado puede ser extremadamente compleja, dado que:
- No existe un biomarcador específico o sensible que identifique a todos o incluso a la mayoría de las personas con EM.
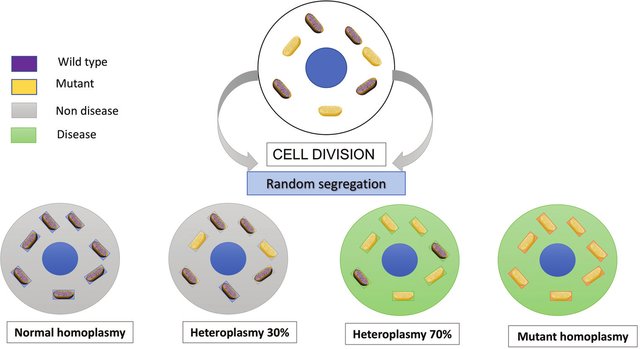
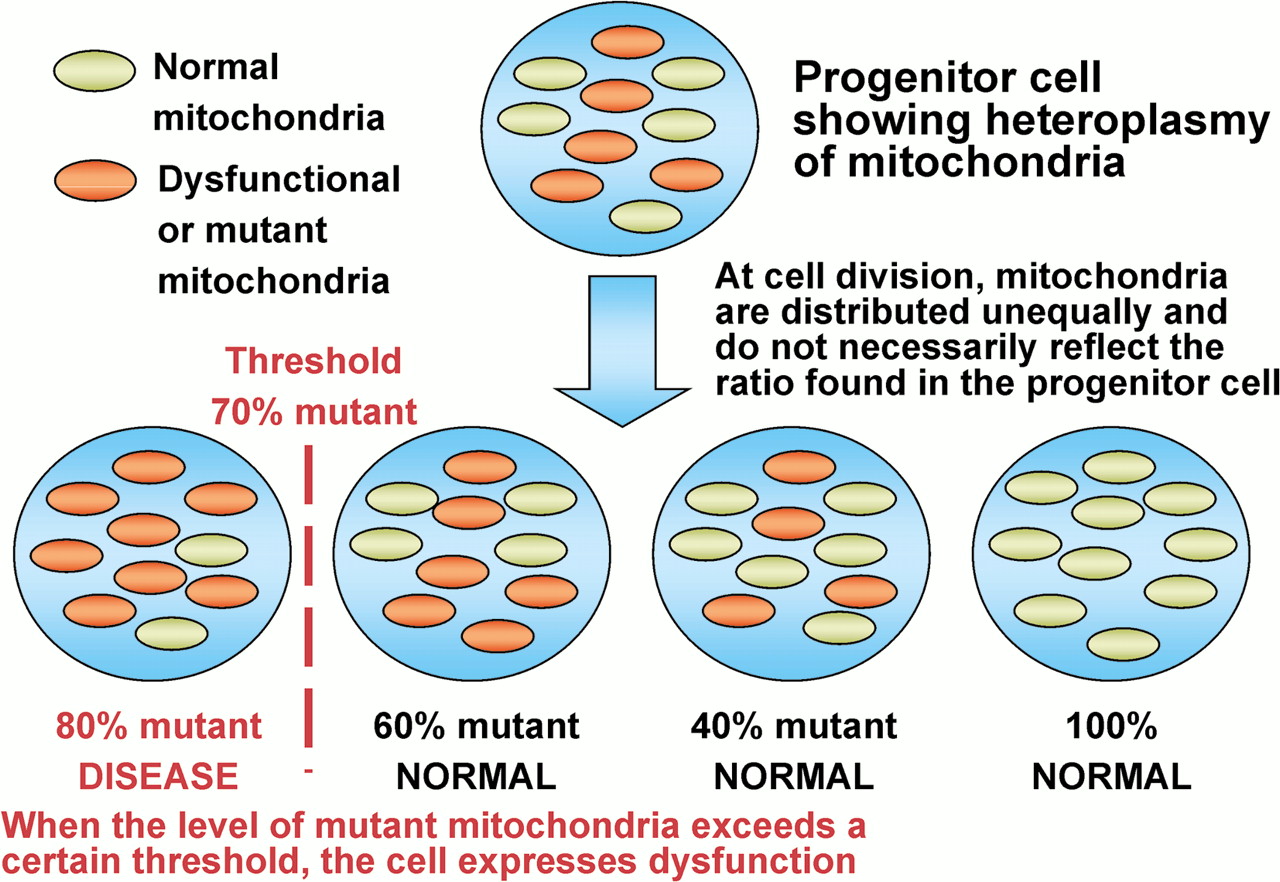
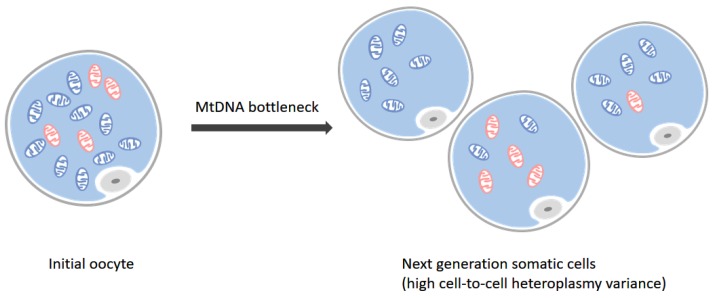
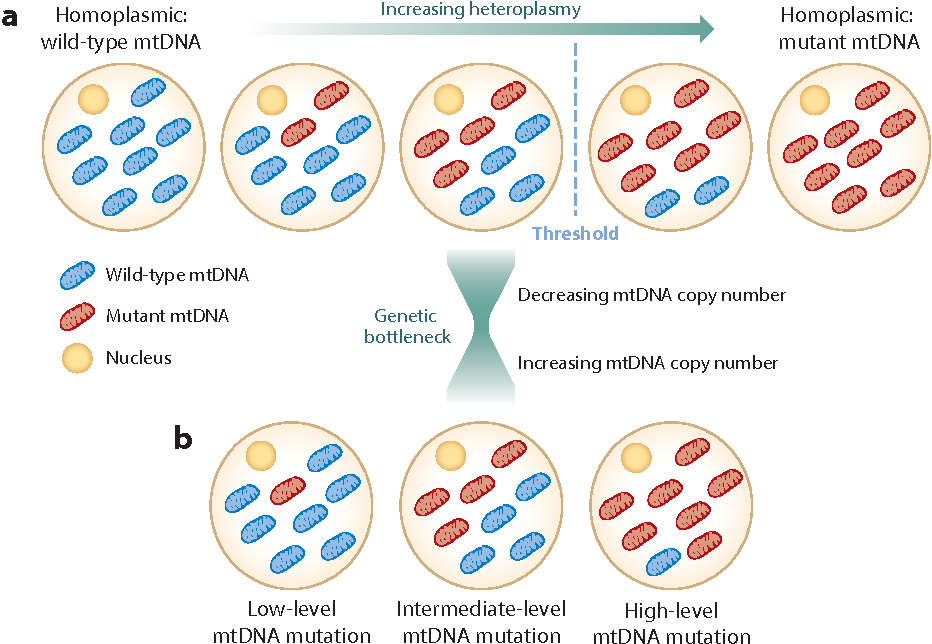
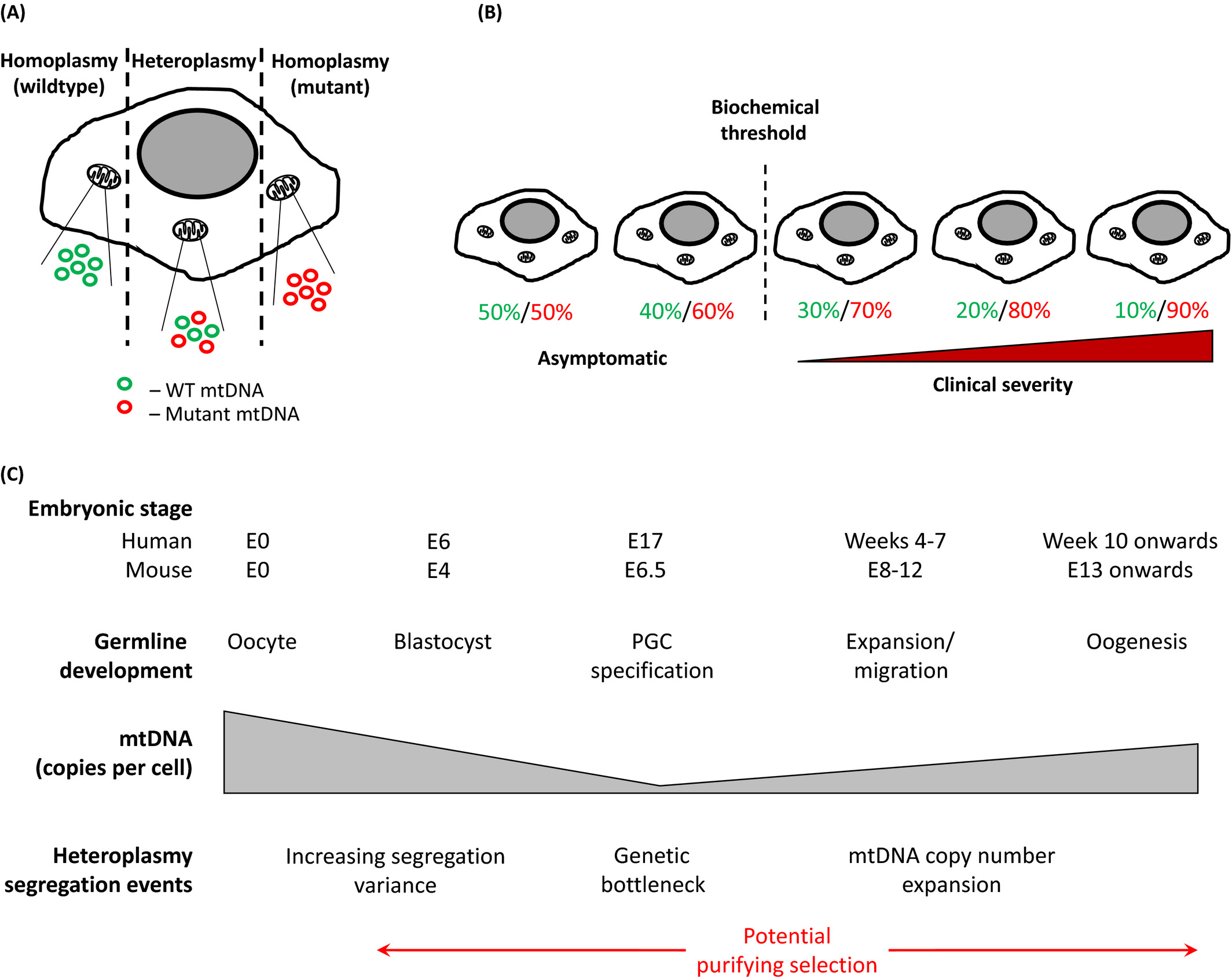
- Puede haber una gran variabilidad en la distribución de mitocondrias anormales dentro de un paciente individual, lo que permite que se produzca un perfil de prueba "falso negativo" cuando los tejidos utilizados para el diagnóstico no contienen las mitocondrias anormales.
- No hay anomalías patológicas uniformes y claras que distingan a todos los pacientes con EM de los pacientes con otros trastornos.
Con el campo de la genética mitocondrial afortunadamente creciendo y expandiéndose, existe la esperanza de que el diagnóstico de enfermedades mitocondriales sea más sencillo con la secuenciación del ADN mitocondrial y nuclear en pacientes.
Aun así, no existen parámetros en la práctica clínica diaria, que los médicos puedan utilizar para el manejo del paciente. La falta de comprensión de la historia natural de la multitud de enfermedades mitocondriales exacerba este dilema.
- La mayoría de los especialistas en medicina mitocondrial han improvisado un conjunto informal de reglas y paradigmas para la atención y el manejo preventivo basados en experiencias anecdóticas y conceptos teóricos;
- la cuestión de ¿cuán apropiadas y necesarias son estas evaluaciones e intervenciones? sigue sin respuesta.
Por último, existe incluso menos evidencia sobre las opciones de tratamiento para estos pacientes. A pesar de la prevalencia relativamente alta de la enfermedad mitocondrial, todavía no existen terapias aprobadas por la FDA (La Administración de Alimentos y Medicamentos es responsable de proteger la salud pública garantizando la seguridad, eficacia y seguridad de los medicamentos, productos biológicos y dispositivos médicos para humanos)
Debido a que la enfermedad mitocondrial puede causar una gama desconcertante de síntomas (fenotipos), estas enfermedades pueden ser difíciles de diagnosticar, incluso para médicos reconocidos.
Desafortunadamente, los profesionales médicos que ejercen actualmente, a menudo se basan en la información que se les proporcionó durante su formación en las Facultades de medicina; esta información solía estar incompleta y ahora está desactualizada. En el mejor de los casos, algunos médicos pueden tener un vago recuerdo de las ENFERMEDADES MITOCONDRIALES. De aquellos dibujos, en que la mitocondria (con aspecto de alubia) se describía como la encargada de suministrar la energía que necesitan las células para funcionar.
A muchos nuevos médicos jóvenes que saben un poco más sobre la Enfermedad, a menudo todavía creen que todos los tipos de Enfermedades mitocondriales son extremadamente raros y piensan que es poco probable que vean un caso en su vida; es casi seguro que no se dan cuenta de que los hallazgos actuales, muestran que son mucho más comunes de lo que se pensaba. Incluso cuando estas condiciones se mencionan en los medios, solo se utilizan casos extremos como ejemplos, lo que refuerza la creencia de la rareza.
Los trastornos mitocondriales alguna vez fueron relegados a la condición de “huérfanos” como temas de pequeños párrafos en los libros de texto de patología y en las prácticas hospitalarias de los subespecialistas. Con la creciente apreciación de la alta frecuencia observada tanto en la atención primaria como especializada, merece la atención de todos los médicos en ejercicio.
"Lo que no se sabe o lo que no se piensa no se diagnostica" se puede aplicar al diagnóstico de enfermedad mitocondrial. Si el médico no piensa que un paciente pude tener una enfermedad mitocondrial, nunca la diagnosticará.
Sin embargo, aún es importante confiar en el juicio clínico y NO exclusivamente en los resultados de pruebas complicadas y a veces poco fiables. Si realmente cree que puede ser un trastorno mitocondrial, no se rinda en primera base.
Probar que un trastorno NO es una enfermedad mitocondrial es aún más difícil y probablemente imposible.
Con el creciente número de datos clínicos, bioquímicos y genéticos sobre la enfermedad mitocondrial primaria, un diagnóstico definitivo "solo debe proporcionarse cuando se haya identificado un defecto genético patogénico confirmado". Los pacientes con evidencia bioquímica y clínica para tal diagnóstico aún deben ser reevaluados periódicamente.
En ausencia de un diagnóstico genético confirmado, los médicos deben usar etiquetas para dejar en claro que el diagnóstico es incierto, recomiendan los investigadores. Es preferible utilizar "diagnóstico genético incierto" junto con una descripción específica de las alteraciones identificadas.
Con la excepción de mutaciones patógenas conocidas en presencia de hallazgos clínicos, es probable que ninguna prueba de laboratorio sea diagnóstica de una enfermedad mitocondrial.
Sin embargo, debido a la rareza y la naturaleza difusa de las enfermedades mitocondriales, es poco probable que la dificultad del diagnóstico desaparezca pronto. La situación puede cambiar cuando las pruebas genéticas se utilicen más ampliamente en los sistemas de atención médica existentes ahora o en el futuro. Teniendo en cuenta estos avances, es importante seguir rastreando los cambios en la odisea diagnóstica de los pacientes con enfermedad mitocondrial; impulsar los esfuerzos para reducir la incertidumbre diagnóstica sobre los pacientes y familiares; e incluir los vínculos entre las pruebas genéticas y los fenotipos congruentes en el trabajo futuro.
REFERENCIAS
- Sophia Zilber and Philip E. Yeske (2020) Mitochondrial Disease Community Registry: First look at the data, perspectives from patients and families. Mitochondrial and Metabolic Medicine 2: doi:10.9777/mmm.2020.10001
- Parikh, S., Goldstein, A., Koenig, M. K., Scaglia F, et al. Practice patterns of mitochondrial disease physicians in North America. Part 1: Diagnostic and clinical challenges Mitochondrion 2014;14:26-33
- Stenton S.L, Prokisch H. Genetics of mitochondrial diseases: Identifying mutations to help diagnosis. EBioMedicine (Lancet) 2020; 56
- Schon K.R, et al. Mitochondrial Diseases: A Diagnostic Revolution. Trends in Genetics, 2020; 36:703-717
PROF. DR. FERNANDO GALAN